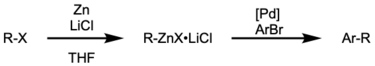Acoplamento Negishi - Negishi coupling
| Acoplamento negishi | |
|---|---|
| Nomeado após | Ei-ichi Negishi |
| Tipo de reação | Reação de acoplamento |
| Identificadores | |
| Portal de Química Orgânica | acoplamento negishi |
| ID de ontologia RSC | RXNO: 0000088 |
O acoplamento Negishi é uma reação de acoplamento cruzado catalisada por metal de transição amplamente utilizada . A reação acopla haletos ou triflatos orgânicos com compostos de organozinco , formando ligações carbono-carbono (cc) no processo. Uma espécie de paládio (0) é geralmente utilizada como o catalisador de metal , embora às vezes o níquel seja usado. Uma variedade de catalisadores de níquel no estado de oxidação Ni 0 ou Ni II podem ser empregados em acoplamentos cruzados Negishi, como Ni (PPh 3 ) 4 , Ni (acac) 2 , Ni (COD) 2 etc.
-
- O grupo de saída X é geralmente cloreto , brometo ou iodeto , mas os grupos triflato e acetiloxi também são viáveis. X = Cl geralmente leva a reações lentas.
- O resíduo orgânico R = alcenilo , arilo , alilo , alcinilo ou propargilo .
- O haleto X ' no composto de organozinco pode ser cloreto , bromo ou iodo e o resíduo orgânico R' é alquenil , aril , alil , alquil , benzil , homoalil e homopropargil.
- O metal M no catalisador é níquel ou paládio
- O ligante L no catalisador pode ser trifenilfosfina , dppe , BINAP ou quirafos
Os catalisadores de paládio em geral têm rendimentos químicos mais altos e tolerância de grupo funcional mais alta .
O acoplamento Negishi encontra uso comum no campo da síntese total como um método para formar seletivamente ligações CC entre intermediários sintéticos complexos. A reação permite o acoplamento de átomos de carbono sp 3 , sp 2 e sp (ver hibridização orbital ), o que a torna um tanto incomum entre as reações de acoplamento catalisadas por paládio . Os organozinco são sensíveis à umidade e ao ar , portanto o acoplamento de Negishi deve ser realizado em um ambiente livre de oxigênio e água, fato que tem dificultado seu uso em relação a outras reações de acoplamento cruzado que requerem condições menos robustas (por exemplo, reação de Suzuki). No entanto, os organozinco são mais reativos do que os organostananos e organoboratos, o que se correlaciona com tempos de reação mais rápidos.
A reação leva o nome de Ei-ichi Negishi, que recebeu o Prêmio Nobel de Química de 2010 pela descoberta e desenvolvimento desta reação.
Negishi e colaboradores investigaram originalmente o acoplamento cruzado de reagentes de organoalumínio em 1976, inicialmente empregando Ni e Pd como os catalisadores de metal de transição, mas observaram que o Ni resultou na decadência da estereoespecificação, enquanto o Pd não. Transição de espécies de organoalumínio para compostos de organozinco Negishi e colaboradores relataram o uso de complexos de Pd em reações de acoplamento de organozinco e realizaram estudos de métodos, eventualmente desenvolvendo as condições de reação naquelas comumente utilizadas hoje. Ao lado de Richard F. Heck e Akira Suzuki , El-ichi Negishi foi co-recebedor do Prêmio Nobel de Química em 2010, por seu trabalho em "acoplamentos cruzados catalisados por paládio em síntese orgânica".
Mecanismo de reação
O mecanismo de reação é pensado para prosseguir através de uma via de acoplamento cruzado catalisada por Pd padrão, começando com uma espécie de Pd (0), que é oxidada a Pd (II) em uma etapa de adição oxidativa envolvendo as espécies de organohalide. Esta etapa prossegue com aril, vinil, alquinil e halogenetos de acil, acetatos ou triflatos, com substratos seguindo taxas relativas de adição oxidativa padrão (I> OTf> Br >> Cl).
O mecanismo real de adição oxidativa não está resolvido, embora existam duas vias prováveis. Acredita-se que uma via prossiga por meio de um mecanismo semelhante ao S N 2 , resultando em estereoquímica invertida. A outra via prossegue por meio de adição combinada e mantém a estereoquímica.
Embora as adições sejam cis-, o complexo Pd (II) se isomeriza rapidamente no complexo trans.
Em seguida, ocorre a etapa de transmetalação, onde o reagente de organozinco troca seu substituinte orgânico pelo haleto do complexo Pd (II), gerando o complexo trans-Pd (II) e um sal haleto de zinco. O substrato de organozinco pode ser aril, vinil, alil, benzil, homoalil ou homopropargil. A transmetalação é geralmente limitante da taxa e uma compreensão mecanicista completa desta etapa ainda não foi alcançada, embora vários estudos tenham lançado luz sobre este processo. Foi recentemente determinado que as espécies de alquilzinco devem passar a formar uma espécie de zincato de ordem superior antes da transmetalação, ao passo que as espécies de arilzinco não. ZnXR e ZnR 2 podem ser usados como reagentes reativos, e Zn é conhecido por preferir quatro complexos de coordenadas, o que significa complexos de Zn coordenados com solvente, como ZnXR (solvente)
2não pode ser excluída a priori . Estudos indicam que existem equilíbrios concorrentes entre os complexos cis- e trans-bis alquil organopaládio, mas que o único intermediário produtivo é o complexo cis.
A última etapa na via catalítica do acoplamento de Negishi é a eliminação redutiva , que se acredita que prossiga por meio de um estado de transição de três coordenadas , produzindo o produto orgânico acoplado e regenerando o catalisador Pd (0). Para que esta etapa ocorra, o complexo cis-alquil organopaládio acima mencionado deve ser formado.
Ambos os haletos de organozinco e compostos de diorganozinco podem ser usados como materiais de partida. Em um sistema modelo, verificou-se que na etapa de transmetalação, o primeiro dá o cis-aduto R-Pd-R 'resultando em eliminação redutiva rápida para o produto, enquanto o último dá o trans-aduto que tem que passar por um trans-cis lento isomerização primeiro.
Uma reação colateral comum é o homocoupling. Em um sistema modelo Negishi, a formação de homocoplamento foi encontrada para ser o resultado de uma segunda reação de transmetalação entre o intermediário diarilmetal e haleto de arilmetal:
- Ar – Pd – Ar '+ Ar' – Zn – X → Ar' – Pd – Ar' + Ar – Zn – X
- Ar' – Pd – Ar '→ Ar' – Ar' + Pd (0) (homoacoplamento)
- Ar – Zn – X + H 2 O → Ar – H + HO – Zn – X (reação acompanhada por desalogenação )
Os sistemas catalisados por níquel podem operar sob diferentes mecanismos dependendo dos parceiros de acoplamento. Ao contrário dos sistemas de paládio que envolvem apenas Pd 0 ou Pd II , os sistemas catalisados por níquel podem envolver níquel em diferentes estados de oxidação. Ambos os sistemas são semelhantes no sentido de que envolvem etapas elementares semelhantes: adição oxidativa, transmetalação e eliminação redutiva. Ambos os sistemas também devem abordar questões de eliminação de β-hidreto e difícil adição oxidativa de eletrófilos de alquil.
Para eletrófilos alquil não ativados, um mecanismo possível é um primeiro mecanismo de transmetalação . Nesse mecanismo, as espécies de alquil-zinco primeiro transmetalariam com o catalisador de níquel. Então, o níquel separaria o haleto do haleto de alquila, resultando no radical alquila e na oxidação do níquel após a adição do radical.
Um fator importante ao contemplar o mecanismo de um acoplamento cruzado catalisado por níquel é que a eliminação redutiva é fácil para as espécies de Ni III , mas muito difícil para as espécies de Ni II . Kochi e Morrell forneceram evidências para isso isolando o complexo Ni II Ni (PEt 3 ) 2 (Me) ( o- tolil), que não sofreu eliminação redutiva com rapidez suficiente para estar envolvido nesta etapa elementar.
Alcance
O acoplamento de Negishi foi aplicado as seguintes sínteses ilustrativas:
- 2,2'-bipiridinas assimétricas de 2-bromopiridina com tetraquis (trifenilfosfina) paládio (0) ,
- bifenil de cloreto de o- tolilzinco e o -iodotolueno e tetraquis (trifenilfosfina) paládio (0),
- 5,7-hexadecadieno de 1-decino e iodeto de ( Z ) -1-hexenila.
O acoplamento de Negishi foi aplicado na síntese de hexaferrocenilbenzeno :
com hexaiodidobenzeno, diferrocenilzinco e tris (dibenzilidenoacetona) dipaládio (0) em tetra-hidrofurano . O rendimento é de apenas 4%, significando um aglomerado substancial ao redor do núcleo de arila.
Em uma nova modificação, o paládio é primeiro oxidado pela halocetona 2-cloro-2-fenilacetofenona 1 e o complexo OPdCl de paládio resultante, em seguida, aceita o composto organozinco 2 e o composto organo - estanho 3 em uma dupla transmetalação :
Condições recentes para a reação de Negishi demonstraram escopo extremamente amplo e tolerância de uma ampla gama de grupos funcionais e núcleos heteroaromáticos e ocorrem em ou próximo à temperatura ambiente.
Exemplos de acoplamentos Negishi catalisados por níquel incluem sistemas sp 2 -sp 2 , sp 2 -sp 3 e sp 3 -sp 3 . No sistema inicialmente estudado por Negishi, o acoplamento cruzado de aril-arila foi catalisado por Ni (PPh 3 ) 4 gerado in situ através da redução de Ni (acac) 2 com PPh3 e (i-Bu) 2 AlH.
Variações também foram desenvolvidas para permitir o acoplamento cruzado de parceiros aril e alquenil. Na variação desenvolvida por Knochel et al, os brometos de aril zinco reagiram com triflatos de vinila e halogenetos de vinila.
As reações entre os centros sp 3 -sp 3 são geralmente mais difíceis; no entanto, a adição de um ligante insaturado com um grupo de retirada de elétrons como um cocatalisador melhorou o rendimento em alguns sistemas. Acredita-se que a coordenação adicionada do ligante insaturado favorece a eliminação redutiva em relação à eliminação de β-hidreto. Isso também funciona em alguns sistemas alquilaril.
Existem várias variantes assimétricas e muitas utilizam ligantes Pybox.
Aplicações industriais
O acoplamento Negishi não é empregado com tanta frequência em aplicações industriais como seus primos, a reação de Suzuki e a reação de Heck , principalmente como resultado da sensibilidade à água e ao ar dos reagentes aril ou alquil-zinco necessários. Em 2003, a Novartis empregou um acoplamento Negishi na fabricação de PDE472, um inibidor da fosfodiesterase tipo 4D, que estava sendo investigado como um medicamento líder para o tratamento da asma . O acoplamento de Negishi foi usado como uma alternativa à reação de Suzuki, proporcionando rendimentos aprimorados, 73% em uma escala de 4,5 kg, do intermediário sintético de benzodioxazol desejado.
Aplicações em síntese total
Onde o acoplamento Negishi raramente é usado na química industrial, como resultado da já mencionada sensibilidade à água e ao oxigênio, ele encontra ampla utilização no campo da síntese total de produtos naturais . A maior reatividade em relação a outras reações de acoplamento cruzado torna o acoplamento de Negishi ideal para unir intermediários complexos na síntese de produtos naturais. Além disso, o Zn é mais ecológico do que outros metais, como o Sn usado no acoplamento Stille . Embora o acoplamento Negishi historicamente não tenha sido usado tanto quanto o acoplamento Stille ou Suzuki, nos últimos anos viu o acoplamento Negishi ganhar uma posição no campo da química sintética , tanto que se tornou o método de acoplamento cruzado preferido para selecionar tarefas sintéticas. Quando se trata de processos de acoplamento de fragmentos, o acoplamento Negishi é particularmente útil, especialmente quando comparado às reações de acoplamento Stille e Suzuki mencionadas anteriormente. A principal desvantagem do acoplamento Negishi, além de sua sensibilidade à água e ao oxigênio, é sua relativa falta de tolerância do grupo funcional em comparação com outras reações de acoplamento cruzado.
(-) - estemoamida é um produto natural encontrado nos extratos de raiz de '' Stemona tuberosa ''. Esses extratos têm sido usados na medicina popular japonesa e chinesa para tratar distúrbios respiratórios, e a (-) - estemoamida também é um anti-helmíntico. Somfai e colegas de trabalho empregaram um acoplamento de Negishi em sua síntese de (-) - estemoamida. A reação foi implementada no meio da síntese, formando uma ligação sp 3 -sp 2 cc entre β, éster γ-insaturado e um dieno intermediário 4 com um rendimento de 78% do produto 5 . Somfai completou a síntese estereosseletiva total de (-) - estemoamida em 12 etapas com um rendimento total de 20%.
Kibayashi e colaboradores utilizaram o acoplamento Negishi na síntese total da Pumiliotoxina B. A Pumiliotoxina B é um dos principais alcalóides tóxicos isolados do Dendrobates pumilio, uma rã venenosa do Panamá. Esses alcalóides tóxicos exibem efeitos modulatórios nos canais de sódio dependentes de voltagem , resultando em atividade cardiotônica e miotônica. Kibayashi empregou o estágio tardio de acoplamento de Negishi na síntese de Pumiliotoxina B, acoplando um carbono sp 3 homoalílico no alquilideno indolizidina 6 de zinco com o iodeto de (E) -vinil 7 com um rendimento de 51%. O produto natural foi então obtido após a desprotecção.
O ácido δ-trans-tocotrienolóico isolado da planta, Chrysochlamys ulei, é um produto natural que inibe a DNA polimerase β (pol β), que funciona para reparar o DNA por meio da excisão de bases. A inibição da pol B em conjunto com outras drogas quimioterápicas pode aumentar a citotoxicidade desses quimioterápicos, levando a dosagens eficazes mais baixas. O acoplamento de Negishi foi implementado na síntese de δ-trans-tocotrienoloic ácido por Hecht e Maloney acoplamento sp 3 homopropargyl zinco reagente 8 com sp 2 vinilo iodeto 9 . A reação prosseguiu com rendimento quantitativo, acoplando fragmentos no meio da síntese a caminho do produto natural ácido δ-trans-tocotrienolóico sintetizado estereosseletivamente.
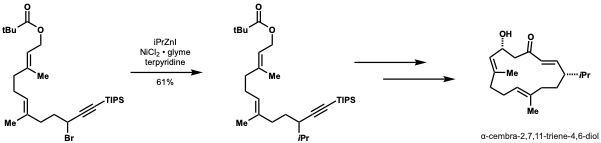
Smith e Fu demonstraram que seu método para acoplar nucleófilos secundários com eletrófilos alquil secundários poderia ser aplicado à síntese formal de α-cembra-2,7,11-trieno-4,6-diol, um alvo com atividade antitumoral. Eles alcançaram um rendimento de 61% em uma escala de gramas usando seu método para instalar um grupo iso- propil. Este método seria altamente adaptável nesta aplicação para diversificação e instalação de outros grupos alquil para permitir estudos de relação estrutura-atividade (SAR).
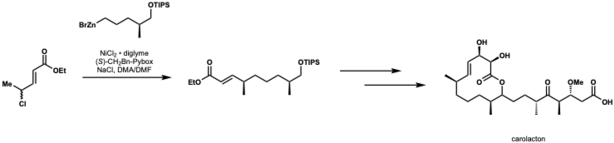
Kirschning e Schmidt aplicaram acoplamento cruzado de negishi catalisado por níquel à primeira síntese total de carolactona. Nesta aplicação, eles alcançaram um rendimento de 82% e dr = 10: 1.
Preparação de precursores de organozinco
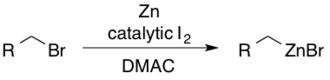
Os reagentes alquilzinco podem ser acessados a partir dos brometos de alquila correspondentes usando iodo em dimetilacetamida (DMAC). O I 2 catalítico serve para ativar o zinco para a adição nucleofílica.
Os aril-zinco podem ser sintetizados usando condições de reação moderadas por meio de um intermediário do tipo Grignard .
Os organozinco também podem ser gerados in situ e usados em um procedimento de um vaso, conforme demonstrado por Knochel et. al.
Veja também
Referências
links externos
- O acoplamento Negishi em www.organic-chemistry.org
















![Preparação de reagente de arilzinco {\ displaystyle {\ begin {matrix} {} \\ {\ ce {Ar-I -> [{\ begin {matrix} {\ ce {iPrMgCl}} \\ {\ text {THF}} \ end {matrix} }] [{\ ce {ZnBr2}}] Ar-ZnBr}} \ end {matriz}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/207cdded6086749bdb7e5dd64cf22c29306ff367)