NiFe hidrogenase - NiFe hydrogenase
A [NiFe] hidrogenase é um tipo de hidrogenase , que é uma enzima oxidativa que converte reversivelmente o hidrogênio molecular em procariotos, incluindo bactérias e arquéias . O sítio catalítico na enzima fornece aos microorganismos metabolizadores de hidrogênio simples um mecanismo redox pelo qual armazenam e utilizam energia por meio da reação mostrada na Figura 1. Isso é particularmente essencial para as bactérias anaeróbias redutoras de sulfato do gênero Desulfovibrio , bem como patogênicas organismos Escherichia coli e Helicobacter pylori . Os mecanismos, maturação e função das [NiFe] hidrogenases estão sendo ativamente pesquisados para aplicações na economia de hidrogênio e como potenciais alvos de antibióticos.
Estrutura
A estrutura da [NiFe] hidrogenase foi obtida a partir de estudos de cristalografia de raios-X de cinco diferentes bactérias redutoras de sulfato: D. vulgaris Miyazaki F, D. gigas , D. frutosovorans , D. desulfuricans e Desulfomicrobium baculatum . A [NiFe] hidrogenase isolada de D. vulgaris Miyazaki F é mostrada na Figura 2. A subunidade maior é em azul, tem uma massa molecular de 62,5 kDa e abriga o sítio ativo de Ni-Fe . A subunidade menor está em magenta, tem uma massa molecular de 28,8 kDa e contém os aglomerados Fe-S (ver aglomerado Ferro-enxofre ).
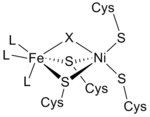
A partir dos espectros de infravermelho e estudos de cristalografia de raios-X , o sítio ativo da [NiFe] hidrogenase foi encontrado para ser (S-Cys) 4 Ni (μ-X) Fe (CO) (CN) 2 , em que o ligante genérico X é ou um óxido , enxofre , hidroperóxido ou um hidróxido encontrado apenas em um estado oxidado (Figura 3). Enquanto o átomo de níquel participa das reações redox, o átomo de ferro está consistentemente em um estado de coordenação Fe (II). A geometria exata dos três ligantes não proteicos (denotados como L) coordenando-se com o íon de metal Fe não é conhecida; entretanto, eles foram identificados como uma molécula de monóxido de carbono (C≡O) e duas moléculas de cianeto ( - C≡N).
Clusters Fe-S
Quase todas as hidrogenases contêm pelo menos um cluster ferro-enxofre ( cluster Fe-S). Como mencionado anteriormente, esses aglomerados de Fe-S conectam o sítio ativo de níquel da enzima à superfície da proteína porque servem como uma cadeia de transporte de elétrons do sítio redox de Ni-Fe para o citocromo c 3 aceptor de elétrons (ver família do citocromo c ) Esses elétrons são produzidos a partir da clivagem heterolítica da molécula de hidrogênio no sítio ativo de Ni-Fe. As estruturas cristalinas da hidrogenase mostram um Fe 3 S 4 no centro da cadeia e um cluster Fe 4 S 4 na superfície molecular. A distância entre o cluster Fe 4 S 4 interno e o site ativo é de aproximadamente 12 Å (Figura 4).
As hidrogenases [NiFe] e [NiFeSe] têm estruturas notavelmente semelhantes, levando à sugestão de que um enxofre em um aglomerado Fe-S foi substituído por um átomo de selênio , mas essas hidrogenases diferem em reatividade catalítica e sensibilidade aos inibidores enzimáticos .

Íon de metal Mg e as vias de prótons
A [NiFe] hidrogenase possui um cátion Mg 2+ ligado na região do terminal C da subunidade maior. Este cátion está ligado a três moléculas de água e três aminoácidos e estabiliza essa região livre de solvente. A aproximadamente 13 Å de distância da porção [NiFe], este cátion conecta o sítio ativo a uma rede de ligações de hidrogênio e serve como uma via de transferência de prótons (H + ).
O canal de acesso ao gás
Estudos nos quais o xenônio foi ligado à hidrogenase sugerem um canal de gás hidrofóbico através do qual os gases H 2 , CO e O 2 poderiam atingir o sítio ativo profundamente enterrado na enzima. A estrutura do cristal revelou vários pequenos canais na superfície, que se combinaram em um canal maior que atingiu o sítio ativo [Ni-Fe].
Uma vez que as hidrogenases são bem conhecidas por serem sensíveis ao oxigênio , a difusão do gás para o sítio ativo depende do tamanho e do ambiente do canal de acesso ao gás, da reação do oxigênio molecular (O 2 ) no sítio ativo e da recuperação do sítio ativo após a oxidação.
Mecanismo
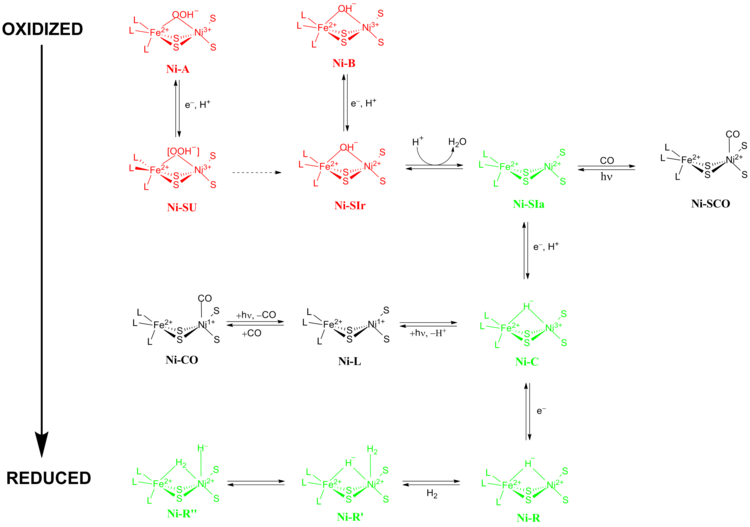
O mecanismo de reação exato das [NiFe] hidrogenases tem sido motivo de grande debate. Em 2009, um mecanismo foi proposto por Higuchi e colaboradores baseado em cristalografia de raios-X e dados espectroscópicos de Desulfovibrio vulgaris Miyazaki F. Durante o processo catalítico, o íon metálico Fe no sítio ativo não muda seu estado de oxidação enquanto o íon metálico Ni participa da química redox. Existem dois grupos principais de estados redox pelos quais as [NiFe] hidrogenases passam durante a catálise 1) Estados redox inativos e 2) Estados redox ativos (Figura 5).
Estados redox inativos
Ni-A (o estado “não preparado” ) e Ni-B (o estado “pronto”) são as formas mais oxidadas do centro metálico [NiFe] e são ativadas por redução de um elétron com transferência de prótons. A taxa de ativação redutiva de Ni-A para Ni-SU pode levar horas, enquanto a taxa de ativação redutiva de Ni-B para Ni-SIr ocorre em segundos. A razão para esta disparidade na cinética de ativação entre Ni-A e Ni-B foi proposta como resultado da diferença nos ligantes de ligação entre os dois estados redox diferentes. No estado Ni-SIr , uma molécula de água foi liberada para formar o estado Ni-SIa , o primeiro estado redox catalítico ativo das [NiFe] hidrogenases.
Estados redox ativos
Os três estados ativos redox catalíticos mais importantes das [NiFe] hidrogenases são Ni-SIa , Ni-C e Ni-R (que têm três variações diferentes :). O estado de Ni-C sensível à luz pode ser obtido através da redução de um elétron de Ni-SIa . Os estudos de espectroscopia de ressonância paramagnética de elétrons do estado Ni-C , que continha um Ni 3+ com S = 1/2 (ver Spin-1/2 ) e um hidreto ligando os dois metais Ni e Fe, mostraram que a clivagem heterolítica de H 2 ocorre no sítio ativo da [NiFe] hidrogenase.
Os estados inibidos por CO
O estado Ni-SIa pode ser inibido por CO, que se liga diretamente ao íon metálico Ni em uma conformação dobrada para formar Ni-SCO (veja abaixo). Como o Ni-C é sensível à luz, após a iluminação a 100K resulta no estado redox de Ni-L . Na presença de CO, Ni-L forma o estado Ni-CO .
Maturação e arranjo genético
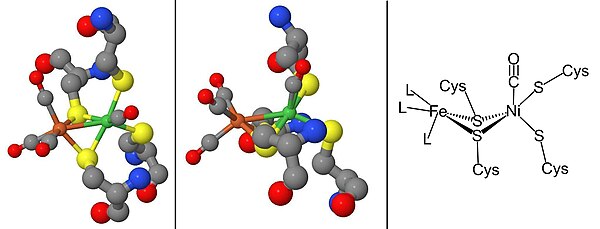
A maturação das [NiFe] hidrogenases requer um conjunto de proteínas acessórias que sintetizam o sítio ativo do NiFe, Figura 2, e modificam a enzima precursora para que tenha a estrutura e localização corretas . A maturação do sítio ativo é de especial interesse por causa da síntese de ligantes de metal cianeto (CN) e monóxido de carbono (CO), que geralmente são tóxicos para os organismos vivos. Esta etapa é concluída pelas proteínas HypC, HypD, HypE e HypF. Depois, a síntese do centro de ferro, níquel é inserido usando metallochaperones Hypa, HypB, e SlyD. Uma vez que o centro catalítico esteja completo, o precursor da hidrogenase sofre uma clivagem C-terminal que leva ao rearranjo de sua estrutura e associação com a pequena subunidade. Finalmente, a enzima completa é transportada para sua posição correta dentro da célula. O promotor da hidrogenase, P SH , pode ser estudado construindo um promotor P SH de fusão gfp usando o gene repórter da proteína fluorescente verde ( gfp) .
Aplicativo
Como a [NiFe] hidrogenase é um membro da família das hidrogenases , essas enzimas podem catalisar o consumo e a produção de hidrogênio. Ao estudar a [NiFe] hidrogenase, os cientistas podem otimizar uma condição na qual a proteína produzirá apenas hidrogênio. Além disso, uma pequena enzima que imita a [NiFe] hidrogenase também pode ser sintetizada para atuar como gerador de gás hidrogênio. A [NiFe] hidrogenase solúvel de Ralstonia eutropha H16 é uma enzima candidata promissora para aplicação de biocombustível à base de H 2 , pois favorece a oxidação de H 2 e é relativamente tolerante ao oxigênio. Pode ser produzido em meio de crescimento heterotrófico e purificado por meio de matrizes de cromatografia de troca aniônica e exclusão de tamanho .