Ligante não inocente - Non-innocent ligand
Em química , um ligante não inocente (redox) é um ligante em um complexo de metal onde o estado de oxidação não é claro. Normalmente, os complexos contendo ligantes não inocentes são redox ativos em potenciais moderados . O conceito assume que as reações redox em complexos de metal são localizadas em metal ou ligante, o que é uma simplificação, embora útil.
CK Jørgensen primeiro descreveu os ligantes como "inocentes" e "suspeitos": "Os ligantes são inocentes quando permitem que os estados de oxidação dos átomos centrais sejam definidos. O caso mais simples de um ligante suspeito é NÃO ..."
Reações redox de complexos de ligantes inocentes vs. não inocentes
Convencionalmente, as reações redox de complexos de coordenação são consideradas centradas no metal. A redução de MnO 4 - a MnO 4 2− é descrita pela mudança no estado de oxidação do manganês de 7+ para 6+. Os ligantes óxidos não mudam no estado de oxidação, permanecendo 2-. O óxido é um ligante inocente. Outro exemplo de par redox convencional centrado em metal é [Co (NH 3 ) 6 ] 3+ / [Co (NH 3 ) 6 ] 2+ . A amônia é inocente nesta transformação.
O comportamento não inocente Redox de ligantes é ilustrado por bis (estilbeneditiolato) de níquel ([Ni (S 2 C 2 Ph 2 ) 2 ] z ). Como todos os complexos bis (1,2-ditioleno) de íons metálicos n d 8 , três estados de oxidação podem ser identificados: z = 2-, 1- e 0. Se os ligantes são sempre considerados dianiônicos (como é feito em contagem do estado de oxidação formal), então z = 0 requer que o níquel tenha um estado de oxidação formal de + IV. O estado de oxidação formal do átomo central de níquel, portanto, varia de + II a + IV nas transformações acima (ver Figura). No entanto, o estado de oxidação formal é diferente do estado de oxidação real (espectroscópico) com base na configuração do elétron-d metálico (espectroscópico). O estilbeno-1,2-ditiolato se comporta como um ligante não inocente redox, e os processos de oxidação ocorrem realmente nos ligantes, e não no metal. Isso leva à formação de complexos de radicais ligantes. O complexo de carga neutra (z = 0), mostrando um caráter diradical singlete parcial, é portanto melhor descrito como uma derivada de Ni 2+ do ânion radical S 2 C 2 Ph 2 • - . O diamagnetismo desse complexo surge do acoplamento anti-ferromagnético entre os elétrons desemparelhados dos dois radicais ligantes. Outro exemplo são os estados de oxidação mais elevados de complexos de cobre de ligantes diamido fenil que são estabilizados por ligações de hidrogênio multicêntricas intramoleculares
Ligantes não inocentes típicos
- Nitrosil (NO) liga-se aos metais em uma das duas geometrias extremas - dobrado onde o NO é tratado como um pseudo-haleto (NO - ), e linear, onde o NO é tratado como NO + .
- O oxigênio pode ser não inocente, pois existe em dois estados de oxidação, superóxido (O 2 - ) e peróxido (O 2 2− ).
Ligantes com deslocalização pi estendida, como porfirinas , ftalocianinas e corroles e ligantes com as fórmulas generalizadas [D-CR = CR-D] n− (D = O, S, NR 'e R, R' = alquil ou aril ) geralmente não são inocentes. Em contraste, [D-CR = CR-CR = D] - como NacNac ou acac são inocentes.
- catecolatos e 1,2-dioxalenos relacionados.
- ditiolenos , como maleonitrileditiolato (ver exemplo de [Ni (S 2 C 2 Ph 2 ) 2 ] n− acima).
- 1,2- diiminas, tais como derivados de 1,2-diamidobenzeno, 2,2'-bipiridina e dimetilglioxima . O complexo Cr ( 2,2'-bipiridina ) 3 é um derivado do Cr (III) ligado a três ligantes de bipiridina 1− . Por outro lado, a oxidação de um elétron de [Ru (2,2'-bipiridina) 3 ] 2+ está localizada em Ru e a bipiridina está se comportando como um ligante inocente normal neste caso.
- ligantes contendo ferroceno podem ter eventos de oxidação centrados no centro de ferro ferroceno, em vez do centro de metal cataliticamente ativo.
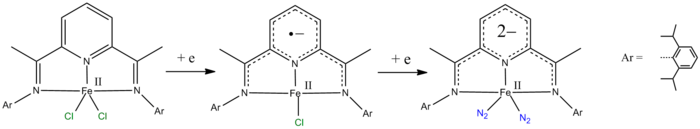
- ligantes piridina-2,6-diimina podem ser reduzidos em um e dois elétrons.
Ligantes não inocentes redox em biologia e catálise homogênea
Em certos processos enzimáticos, os cofatores não inocentes redox fornecem equivalentes redox para complementar as propriedades redox das metaloenzimas. Claro, a maioria das reações redox na natureza envolve sistemas inocentes, por exemplo, clusters [4Fe-4S] . Os equivalentes redox adicionais fornecidos por ligantes não inocentes redox também são usados como fatores de controle para orientar a catálise homogênea.
Hemes

Ligantes de porfirina podem ser inocentes (2-) ou não inocentes (1-). No enzimas cloroperoxidase e do citocromo P450 , a porfirina ligando sustenta oxidação durante o ciclo catalítico, designadamente na formação de Composto I . Em outras proteínas heme , como a mioglobina , o redox centrado no ligante não ocorre e a porfirina é inocente.
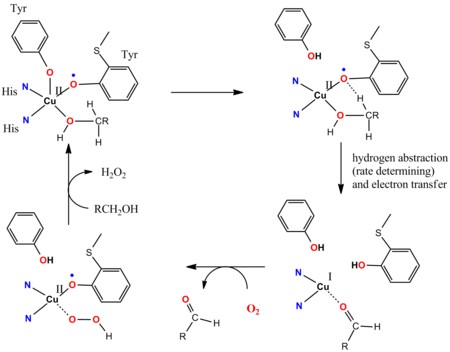
Galactose oxidase
O ciclo catalítico da galactose oxidase (GOase) ilustra o envolvimento de ligantes não inocentes. GOase oxida álcoois primários em aldeídos usando O 2 e liberando H 2 O 2 . O sítio ativo da enzima GOase apresenta uma tirosila coordenada a um íon Cu II . Nas etapas principais do ciclo catalítico, um local de ligante básico de Brønsted cooperativo desprotona o álcool e, subsequentemente, o átomo de oxigênio do radical tirosinil abstrai um átomo de hidrogênio da funcionalidade alfa-CH do substrato alcóxido coordenado. O radical tirosinil participa do ciclo catalítico: a oxidação 1e é efetuada pelo par Cu (II / I) e a oxidação 1e é efetuada pelo radical tirosil, dando uma mudança 2e geral. A abstração radical é rápida. O acoplamento anti-ferromagnético entre os spins desemparelhados do ligante do radical tirosina e o centro d 9 Cu II dá origem ao estado fundamental diamagnético, consistente com os modelos sintéticos.
Veja também
Referências
- ^ Ganguly, Sumit; Ghosh, Abhik (16/07/2019). "Seven Clues to Ligand Noninnocence: The Metallocorrole Paradigm". Contas de pesquisa química . 52 (7): 2003–2014. doi : 10.1021 / acs.accounts.9b00115 . ISSN 0001-4842 . PMID 31243969 .
- ^ Jørgensen CK (1966). "Diferenças entre os quatro ligantes de haleto e comentários de discussão sobre complexos trigonal-bipiramidais, em estados de oxidação e em elementos diagonais de energia de um elétron". Revisões de Química de Coordenação . 1 (1–2): 164–178. doi : 10.1016 / S0010-8545 (00) 80170-8 .
- ^ Embora um exame mais cuidadoso da estrutura eletrônica dos parceiros redox revele que os ligantes óxidos são afetados pela mudança redox, este efeito é mínimo e o estado de oxidação formal do oxigênio permanece o mesmo.
- ^ Aragoni, M. Carla; Caltagirone, Claudia; Lippolis, Vito; Podda, Enrico; Slawin, Alexandra MZ; Woollins, J. Derek; Pintus, Anna; Arca, Massimiliano (2020-12-07). "Diradical Character of Neutral Heteroleptic Bis (1,2-dithiolene) Metal Complexes: Case Study of [Pd (Me2timdt) (mnt)] (Me2timdt = 1,3-Dimetil-2,4,5-tritioxoimidazolidina; mnt2– = 1 , 2-Diciano-1,2-etilenoditiolato) " . Química Inorgânica . 59 (23): 17385–17401. doi : 10.1021 / acs.inorgchem.0c02696 . ISSN 0020-1669 . PMC 7735710 . PMID 33185438 .
- ^ Rajabimoghadam, Khashayar; Darwish, Yousef; Bashir, Umyeena; Pitman, Dylan; Eichelberger, Sidney; Siegler, Maxime A .; Swart, Marcel; Garcia-Bosch, Isaac (2018). "Oxidação aeróbia catalítica de álcoois por complexos de cobre contendo ligantes redox-ativos com grupos de ligação H ajustáveis" . Journal of the American Chemical Society . 140 (48): 16625–16634. doi : 10.1021 / jacs.8b08748 . PMC 6645702 . PMID 30400740 .
- ^ Kaim W, Schwederski B (2010). "Ligantes não inocentes na química bioinorgânica - uma visão geral". Revisões de Química de Coordenação . 254. (13-14) (13–14): 1580–1588. doi : 10.1016 / j.ccr.2010.01.009 .
- ^ Ghosh, Abhik (22/02/2017). "Electronic Structure of Corrole Derivatives: Insights from Molecular Structures, Spectroscopy, Electrochemistry, and Quantum Chemical Calculations". Revisões químicas . 117 (4): 3798–3881. doi : 10.1021 / acs.chemrev.6b00590 . ISSN 0009-2665 .
- ^ Zanello P, Corsini M (2006). "Homolépticos, complexos mononucleares de metais de transição de 1,2-dioxolenos: Atualizando suas propriedades eletroquímicas para estruturais (raios X)". Revisões de Química de Coordenação . 250 (15–16): 2000–2022. doi : 10.1016 / j.ccr.2005.12.017 .
- ^ Wang X, Thevenon A, Brosmer JL, Yu I, Khan SI, Mehrkhodavandi P, Diaconescu PL (agosto de 2014). "Controle redox da atividade de polimerização de abertura do anel de metal do grupo 4 para L-lactídeo e ε-caprolactona" . Geléia. Chem. Soc . 136 (32): 11264–7. doi : 10.1021 / ja505883u . PMID 25062499 .
- ^ de Bruin B, Bill E, Bothe E, Weyhermüller T, Wieghardt K (junho de 2000). "Estruturas moleculares e eletrônicas de complexos de bis (piridina-2,6-diimina) metal [ML2] (PF6) n (n & # 61; 0, 1, 2, 3; M & # 61; Mn, Fe, Co, Ni, Cu, Zn) ". Inorg Chem . 39 (13): 2936–47. doi : 10.1021 / ic000113j . PMID 11232835 .
- ^ Chirik PJ, Wieghardt K (fevereiro de 2010). "Chemistry. Radical ligands conferem nobreza em base-metal catalysts". Ciência . 327 (5967): 794–5. doi : 10.1126 / science.1183281 . PMID 20150476 .
- ^ Lyaskovskyy V, de Bruin B (2012). "Redox Non-Innocent Ligands: Versatile New Tools to Control Catalytic Reactions". ACS Catalysis . 2 (2): 270–279. doi : 10.1021 / cs200660v .
- ^ Luca OU, Crabtree RH (fevereiro de 2013). "Redox-active ligands in catysis". Chem Soe Rev . 42 (4): 1440–59. doi : 10.1039 / c2cs35228a . PMID 22975722 .
- ^ Chirila, Andrei; Das, Braja Gopal; Kuijpers, Petrus F .; Sinha, Vivek; Bruin, Bas de (2018), "Application of Stimuli-Responsive and" Non-innocent "Ligands in Base Metal Catalysis", Non-Noble Metal Catalysis , John Wiley & Sons, Ltd, pp. 1-31, doi : 10.1002 / 9783527699087.ch1 , ISBN 9783527699087
- ^ Whittaker MM, Whittaker JW (março de 1993). "Ligando interações com galactose oxidase: percepções mecanicistas" . Biophys. J . 64 (3): 762–72. Bibcode : 1993BpJ .... 64..762W . doi : 10.1016 / S0006-3495 (93) 81437-1 . PMC 1262390 . PMID 8386015 .
- ^ Wang Y, DuBois JL, Hedman B, Hodgson KO, Stack TD (janeiro de 1998). "Catalytic galactose oxidase models: biomimetic Cu (II) -phenoxyl-radical reactivity". Ciência . 279 (5350): 537–40. Bibcode : 1998Sci ... 279..537W . doi : 10.1126 / science.279.5350.537 . PMID 9438841 .
- ^ Müller J, Weyhermüller T, Bill E, Hildebrandt P, Ould-Moussa L, Glaser T, Wieghardt K (março de 1998). "Por que a forma ativa da galactose oxidase possui um estado fundamental diamagnético?". Angew. Chem. Int. Ed. Engl . 37 (5): 616–619. doi : 10.1002 / (SICI) 1521-3773 (19980316) 37: 5 <616 :: AID-ANIE616> 3.0.CO; 2-4 . PMID 29711069 .
Leitura adicional
- Dzik, WI .; Zhang, XP; de Bruin, B. (2011). "Redox Noninnocence of Carbene Ligands: Carbene Radicals in (Catalytic) CC Bond Formation". Química Inorgânica . 50 (20): 9896–9903. doi : 10.1021 / ic200043a . PMID 21520926 .
- Büttner, T .; Geier, J .; Frison, G .; Harmer, J .; Calle, C .; Schweiger, A .; Schönberg, H .; Grützmacher, H. (2005). "Um complexo de metal radical aminílico estável". Ciência . 307. 307 (5707): 235–238. Bibcode : 2005Sci ... 307..235B . doi : 10.1126 / science.1106070 . PMID 15653498 .
- Hetterscheid, DGH; Kaiser, J .; Reijerse, E .; Peters, TPJ; Thewissen, S .; Blok, ANJ; Smits, JMM; de Gelder, R .; de Bruin, B. (2005). "Ir II (eteno): Metal ou Carbono Radical?". Journal of the American Chemical Society . 127 (6): 1895–1905. doi : 10.1021 / ja0439470 . PMID 15701024 .
- Blanchard, S .; Derat, E .; Desage-El Murr, M .; Fensterbank, L .; Malacria, M; Mouriès-Mansuy, V. (2012). "Ligantes Não Inocentes: Novas Oportunidades na Catálise de Ferro". European Journal of Inorganic Chemistry . 2012 (3): 376–389. doi : 10.1002 / ejic.201100985 .
- Kaim, W. (2012). "The Shrinking World of Innocent Ligands: Conventional and Non-Conventional Redox-Active Ligands". European Journal of Inorganic Chemistry . 2012 (3): 343–348. doi : 10.1002 / ejic.201101359 .