Oxyanion - Oxyanion
Um oxiânion , ou oxoanião , é um íon com a fórmula genérica A
xOz -
y(onde A representa um elemento químico e O representa um átomo de oxigênio ). Os oxiânions são formados por uma grande maioria dos elementos químicos . As fórmulas de oxiânions simples são determinadas pela regra do octeto . O oxiácido correspondente de um oxiânion é o composto H
zUMA
xO
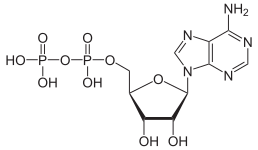
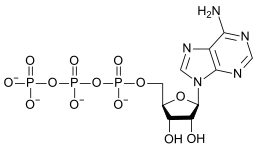
y. As estruturas de oxiânions condensados podem ser racionalizadas em termos de unidades poliédricas AO n com compartilhamento de cantos ou bordas entre os poliedros. Os oxiânions (especificamente, ésteres de fosfato e polifosfato) monofosfato de adenosina ( AMP ), difosfato de adenosina ( ADP ) e trifosfato de adenosina (ATP) são importantes na biologia.
Oxiânions monoméricos
A fórmula de oxiânions monoméricos , AOm -
n, é ditado pelo estado de oxidação do elemento A e sua posição na tabela periódica . Os elementos da primeira linha são limitados a um número máximo de coordenação de 4. No entanto, nenhum dos elementos da primeira linha tem um oxiânion monomérico com esse número de coordenação. Em vez disso, carbonato ( CO2−
3) e nitrato ( NO-
3) têm uma estrutura planar trigonal com ligação π entre o átomo central e os átomos de oxigênio. Essa ligação π é favorecida pela similaridade de tamanho do átomo central e do oxigênio.
Os oxiânions dos elementos da segunda linha no estado de oxidação do grupo são tetraédricos . SiO tetraédrico
4unidades são encontradas em minerais de olivina , [Mg, Fe] SiO
4, mas o ânion não tem uma existência separada, pois os átomos de oxigênio são rodeados tetraedricamente por cátions no estado sólido. Fosfato ( PO3−
4), sulfato ( SO2−
4), e perclorato ( ClO-
4) iões podem ser encontrados como tais em vários sais. Muitos oxiânions de elementos em estado de oxidação inferior obedecem à regra do octeto e isso pode ser usado para racionalizar as fórmulas adotadas. Por exemplo, o cloro (V) tem dois elétrons de valência, então pode acomodar três pares de elétrons de ligações com íons de óxido. A carga do íon é +5 - 3 × 2 = −1 e, portanto, a fórmula é ClO-
3. A estrutura do íon é prevista pela teoria VSEPR como piramidal, com três pares de elétrons de ligação e um par solitário. De forma semelhante, o oxiânion de cloro (III) tem a fórmula ClO-
2, e é dobrado com dois pares solitários e dois pares de ligação.
| Estado de oxidação | Nome | Fórmula | Imagem |
|---|---|---|---|
| +1 | O íon hipoclorito | ClO - |

|
| +3 | O íon clorito |
ClO- 2 |

|
| +5 | O íon clorato |
ClO- 3 |

|
| +7 | O íon perclorato |
ClO- 4 |

|
Na terceira linha e nas subsequentes da tabela periódica, a coordenação 6 é possível, mas os oxiânions octaédricos isolados não são conhecidos porque carregariam uma carga elétrica muito alta. Assim, o molibdênio (VI) não forma MoO6−
6, mas forma o ânion molibdato tetraédrico , MoO2−
4. MoO 6 unidades são encontradas em molibdatos condensados. Oxiânions totalmente protonados com uma estrutura octaédrica são encontrados em espécies como Sn (OH)2−
6e Sb (OH)-
6. Além disso, o ortoperiodato pode ser apenas parcialmente protonado, com H
3IO2−
6|| ⇌ || H
2IO3−
6|| + H + com p K a = 11,60.
Nomeação
A nomeação de oxiânions monoméricos segue as seguintes regras.
- Se o átomo central não estiver no Grupo VII ou VIII
| Número de oxidação do átomo central | Esquema de nomenclatura | Exemplos |
|---|---|---|
| = Número do grupo | *-comi |
Borato ( BO3− 3), Carbonato ( CO2− 3), Nitrato ( NO- 3), Fosfato ( PO3− 4), Sulfato ( SO2− 4), Cromato ( CrO2− 4), Arseniato ( AsO3− 4), Ferrato ( FeO2− 4) |
| = Número do grupo - 2 | *-eu te |
Nitrito ( NÃO- 2), Fosfito ( PO3− 3), Sulfito ( SO2− 3), Arsenito ( AsO3− 3) |
| = Número do grupo - 4 | hypo - * - ite |
Hipofosfito ( PO3− 2), Hipossulfito ( SO2− 2) |
- Se o átomo central estiver no Grupo VII ou VIII
| Número de oxidação do átomo central | Esquema de nomenclatura | Exemplos |
|---|---|---|
| = Número do grupo | por - * - comeu |
Perclorato ( ClO- 4), Perbromato ( BrO- 4), Periodato ( IO- 4), Permanganato ( MnO- 4), Perxenato ( XeO4− 6) |
| = Número do grupo - 2 | *-comi |
Clorato ( ClO- 3), Bromato ( BrO- 3), Iodato ( IO- 3) |
| = Número do grupo - 4 | *-eu te |
Clorito ( ClO- 2), Bromite ( BrO- 2) |
| = Número do grupo - 6 | hypo - * - ite | Hipoclorito (ClO - ), Hipobromito (BrO - ) |
Reações de condensação
Em solução aquosa, os oxiânions com alta carga podem sofrer reações de condensação, como na formação do íon dicromato , Cr
2O2−
7:
- 2 CrO2−
4+ 2 H + ⇌ Cr
2O2−
7+ H 2 S
A força motriz para essa reação é a redução da densidade da carga elétrica no ânion e a eliminação do íon H + . A quantidade de ordem na solução é diminuída, liberando uma certa quantidade de entropia que torna a energia livre de Gibbs mais negativa e favorece a reação direta. É um exemplo de uma reação ácido-base com o oxiânion monomérico atuando como uma base e o oxiânion condensado atuando como seu ácido conjugado . A reação reversa é uma reação de hidrólise , quando uma molécula de água , atuando como uma base, é dividida. Pode ocorrer condensação adicional, particularmente com ânions de carga mais alta, como ocorre com os fosfatos de adenosina.

|
|
|
| AMP | ADP | ATP |
A conversão de ATP em ADP é uma reação de hidrólise e é uma importante fonte de energia em sistemas biológicos.
A formação da maioria dos minerais de silicato pode ser vista como resultado de uma reação de descondensação na qual a sílica reage com um óxido básico, uma reação ácido-base no sentido Lux-Flood .
- CaO (base) + SiO 2 (ácido) → CaSiO 3
Estruturas e fórmulas de polioxianions
Um polioxianião é um oxiânion polimérico no qual vários monômeros de oxiânion, geralmente considerados como poliedros MO n , são unidos por cantos ou bordas compartilhadas. Quando dois cantos de um poliedro são compartilhados, a estrutura resultante pode ser uma cadeia ou um anel. Cadeias curtas ocorrem, por exemplo, em polifosfatos . Os inosilicatos, como os piroxênios , têm uma longa cadeia de tetraedros de SiO 4, cada um compartilhando dois cantos. A mesma estrutura ocorre nos chamados meta-vanadatos, como o metavanadato de amônio , NH 4 VO 3 .
A fórmula do oxiânion SiO2−
3é obtido da seguinte maneira: cada íon de silício nominal (Si 4+ ) está ligado a dois íons de óxido nominais (O 2− ) e tem meia participação em dois outros. Assim, a estequiometria e carga são dadas por:
- Estequiometria: Si + 2 O + (2 × 1 ⁄ 2 ) O = SiO 3
- Carga: +4 + (2 × −2) + (2 × ( 1 ⁄ 2 × −2)) = −2.
Um anel pode ser visto como uma cadeia na qual as duas extremidades foram unidas. Trifosfato cíclico , P
3O3−
9 é um exemplo.
Quando três cantos são compartilhados, a estrutura se estende em duas dimensões. Nos anfibólios , (dos quais o amianto é um exemplo), duas cadeias são unidas pelo compartilhamento de um terceiro canto em locais alternados ao longo da cadeia. Isso resulta em uma fórmula ideal Si
4O6-
11e uma estrutura de cadeia linear que explica a natureza fibrosa desses minerais. O compartilhamento de todos os três cantos pode resultar em uma estrutura de folha, como na mica , Si
2O2−
5, em que cada silício tem um oxigênio para si e meia parte em três outros. A mica cristalina pode ser clivada em folhas muito finas.
O compartilhamento de todos os quatro cantos do tetraedro resulta em uma estrutura tridimensional, como no quartzo . Aluminossilicatos são minerais nos quais algum silício é substituído por alumínio. Porém, o estado de oxidação do alumínio é um a menos que o do silício, portanto a substituição deve ser acompanhada pela adição de outro cátion. O número de combinações possíveis de tal estrutura é muito grande, o que é, em parte, a razão pela qual existem tantos aluminossilicatos.
As unidades octaédricas MO 6 são comuns em oxiânions dos metais de transição maiores. Alguns compostos, como sais do íon polimérico em cadeia, Mo
2O2−
7ainda contêm unidades tetraédricas e octaédricas. O compartilhamento de borda é comum em íons contendo blocos de construção octaédricos e os octaedros são geralmente distorcidos para reduzir a tensão nos átomos de oxigênio em ponte. Isso resulta em estruturas tridimensionais chamadas polioxometalatos . Exemplos típicos ocorrem na estrutura Keggin do íon fosfomolibdato . O compartilhamento de borda é um meio eficaz de reduzir a densidade de carga elétrica, como pode ser visto com a reação de condensação hipotética envolvendo dois octaedros:
- 2 MOn -
6+ 4 H + → Mo
2O( n −4) -
10+ 2 H 2 O
Aqui, a carga média em cada átomo M é reduzida em 2. A eficácia do compartilhamento de bordas é demonstrada pela seguinte reação, que ocorre quando uma solução aquosa alcalina de molibdato é acidificada.
- 7 MoO2−
4+ 8 H + ⇌ Mo
7O6−
244 + H 2 O
O íon molibdato tetraédrico é convertido em um aglomerado de 7 octaedros ligados por borda, dando uma carga média em cada molibdênio de 6 ⁄ 7 . O aglomerado de heptamolibdato é tão estável que não foram detectados aglomerados com 2 a 6 unidades de molibdato, embora devam ser formados como intermediários.
Heurística para acidez
O pKa dos ácidos relacionados pode ser calculado a partir do número de ligações duplas ao oxigênio. Assim, o ácido perclórico é um ácido muito forte, enquanto o ácido hipocloroso é muito fraco. Uma regra simples geralmente funciona com cerca de 1 unidade de pH.
Propriedades ácido-base
A maioria dos oxiânions são bases fracas e podem ser protonados para dar ácidos ou sais de ácido. Por exemplo, o íon fosfato pode ser protonado sucessivamente para formar ácido fosfórico.
-
PO3−
4+ H + ⇌ HPO2−
4 -
HPO2−
4+ H + ⇌ H
2PO-
4 -
H
2PO-
4+ H + ⇌ H 3 PO 4
A extensão da protonação em solução aquosa dependerá das constantes de dissociação ácida e do pH . Por exemplo, AMP (monofosfato de adenosina) tem um valor de ap K de 6,21, então em pH 7 será cerca de 10% protonado. A neutralização de carga é um fator importante nessas reações de protonação. Em contraste, os íons perclorato e permanganato de ânions univalentes são muito difíceis de protonar e, portanto, os ácidos correspondentes são ácidos fortes .
Embora ácidos como o ácido fosfórico sejam escritos como H 3 PO 4 , os prótons estão ligados a átomos de oxigênio formando grupos hidroxila, então a fórmula também pode ser escrita como OP (OH) 3 para refletir melhor a estrutura. O ácido sulfúrico pode ser escrito como O 2 S (OH) 2 ; esta é a molécula observada na fase gasosa.
O íon fosfito , PO3−
3, é uma base forte e, portanto, sempre carrega pelo menos um próton. Neste caso, o próton está ligado diretamente ao átomo de fósforo com a estrutura HPO2−
3. Ao formar este íon, o íon fosfito está se comportando como uma base de Lewis e doando um par de elétrons ao ácido de Lewis, H + .
Como mencionado acima, uma reação de condensação também é uma reação ácido-base. Em muitos sistemas, podem ocorrer reações de protonação e condensação. O caso do íon cromato fornece um exemplo relativamente simples. No diagrama de predominância para cromato, mostrado à direita, pCr representa o logaritmo negativo da concentração de cromo e pH representa o logaritmo negativo da concentração de íons H + . Existem dois equilíbrios independentes. As constantes de equilíbrio são definidas como segue.
CrO2−
4+ H + ⇌ HCrO-
4log K 1 = 5,89 2 HCrO-
4⇌ Cr
2O2−
7+ H 2 Slog K 2 = 2,05
O diagrama de predominância é interpretado da seguinte maneira.
- O íon cromato, CrO2−
4, é a espécie predominante em pH alto. À medida que o pH aumenta, o íon cromato torna-se cada vez mais predominante, até ser a única espécie em soluções com pH> 6,75. - Em pH <p K 1, o íon cromato de hidrogênio, HCrO-
4 é predominante em solução diluída. - O íon dicromato, Cr
2O2−
7, é predominante em soluções mais concentradas, exceto em pH alto.
As espécies H 2 CrO 4 e HCr
2O-
7 não são mostrados porque são formados apenas em pH muito baixo.
Os diagramas de predominância podem se tornar muito complicados quando muitas espécies poliméricas podem ser formadas, como em vanadatos , molibdatos e tungstatos . Outra complicação é que muitos dos polímeros superiores são formados de forma extremamente lenta, de modo que o equilíbrio pode não ser atingido mesmo em meses, levando a possíveis erros nas constantes de equilíbrio e no diagrama de predominância.







![{\ displaystyle K_ {1} = {\ frac {[\ mathrm {HCrO_ {4} ^ {-}}]} {[\ mathrm {CrO_ {4} ^ {2-}}] [\ mathrm {H ^ { +}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/58c28311b8a8a69931b4cfa144888a4d9e4306b1)
![K_ {2} = {\ frac {[{\ mathrm {Cr_ {2} O_ {7} ^ {{2 -}}}}]} {[{\ mathrm {HCrO_ {4} ^ {-}}}] ^ {2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8247e0ecc828c99522eb74cce96893d4a0ca1f60)