PBT2 - PBT2
|
|
| Nomes | |
|---|---|
|
Nome IUPAC preferido
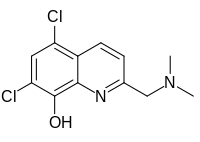
5,7-Dicloro-2 - [(dimetilamino) metil] quinolin-8-ol |
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| ChemSpider | |
|
PubChem CID
|
|
| UNII | |
|
|
|
|
| Propriedades | |
| C 12 H 12 Cl 2 N 2 O | |
| Massa molar | 271,14 g · mol −1 |
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|
| Referências da Infobox | |
PBT2 é um ionóforo de zinco seguro para uso humano e um candidato a medicamento experimental. É um análogo de 8-hidroxiquinolina de segunda geração destinado a ser um sucessor do clioquinol e um potencial tratamento da doença de Alzheimer e da doença de Huntington .
Testes clínicos
PBT2 foi o assunto de três ensaios clínicos de fase II para a doença de Alzheimer ('EURO'), 'IMAGINE' e 'IMAGINE EXTENSION') e um ensaio para a doença de Huntington ('REACH2HD').
Os resultados da eficácia da cognição para a doença de Alzheimer foram mistos. O estudo EURO mostrou algumas melhorias nas funções cognitivas, em domínios específicos das funções executivas, enquanto o estudo IMAGINE não. Embora não haja nenhuma evidência de que o PBT2 seja de algum benefício na demência de Alzheimer, o número de indivíduos tratados com PBT2 para AD em ensaios clínicos controlados com placebo de Fase II (N ~ 76) é limitado e os ensaios não foram capacitados para detectar resultados cognitivos. No ensaio PBT2 de Fase II na doença de Huntington, enquanto o composto cognitivo geral medido não foi melhorado, um domínio de função executiva dentro do composto foi significativamente melhorado.
Estudos de Fase II em AD
PBT2-201 (EURO) foi um estudo de 12 semanas, randomizado, duplo-cego, controlado por placebo, de três grupos paralelos (Fase II) para avaliar a segurança, tolerabilidade e eficácia de dois níveis de dose de PBT2 para retardar a progressão da doença em pacientes com DA precoce. Setenta e oito (78) pacientes foram inscritos e todos foram avaliados quanto à segurança e eficácia. O tratamento com PBT2 de 50 e 250 mg por dia foi bem tolerado em pacientes com DA durante 12 semanas de tratamento, com alguma evidência de que a dose de 250 mg / dia de PBT2 pode modular certos biomarcadores associados à DA, notadamente uma diminuição significativa nos níveis de Abeta no LCR, e melhoria nos aspectos da função cognitiva, conforme medido pelo escore z composto de Função Executiva e os testes individuais do Teste de Criação de Trilhas (TMT) Parte B e dos testes de Fluência de Categoria.
PBT2-204 (IMAGINE) foi um estudo de imagem amilóide cerebral de 12 meses no qual pacientes com DA leve (n = 42) receberam PBT2 250 mg ou placebo. Quarenta e dois (42) pacientes foram inscritos e todos foram avaliados quanto à segurança e eficácia. PBT2 mostrou-se seguro e muito bem tolerado ao longo de 52 semanas, com o perfil de eventos adversos equivalente entre os grupos de placebo e tratados. Não houve diferença nos níveis de amiloide no cérebro entre os grupos tratados com PBT2 e placebo, conforme medido pelo PiB.
PBT2-204-Ext (extensão) Trinta e três (n = 33) pacientes continuaram com 250 mg de PBT2 em um estudo de extensão aberto e foram avaliados quanto à segurança e eficácia, com n = 27 pacientes completando o estudo. Os achados de segurança indicam que o tratamento de longo prazo (até 104 semanas) com PBT2 250 mg foi bem tolerado em pacientes com AD prodrômica ou leve. Os achados de segurança deste estudo são consistentes com aqueles que seriam esperados em uma população de adultos idosos com DA prodrômica ou leve.
Estudo de fase II em HD
PBT2-203 (Reach2HD) foi um estudo de segurança, tolerabilidade e eficácia de 6 meses em HD. Pacientes com HD em estágio inicial a intermediário (n = 109) receberam PBT2 100 mg, PBT2 250 mg ou placebo uma vez ao dia. O objetivo principal do estudo foi avaliar a segurança e tolerabilidade de dois níveis de dose de PBT2 (100 mg e 250 mg, uma vez ao dia) em comparação com Placebo após 26 semanas em participantes com HD inicial a intermediária. PBT2 mostrou-se seguro e bem tolerado ao longo de 26 semanas, com o perfil de eventos adversos equivalente entre os grupos de placebo e PBT2.
Os objetivos secundários do estudo centraram-se nos sintomas ou manifestações específicas da DH. O objetivo primário de eficácia do estudo foi determinar o efeito de PBT2 na cognição, conforme medido por uma bateria de testes cognitivos que consiste em Teste de Fluência de Categoria, TMT Partes A e B, Pesquisa de Mapa, Teste de Modalidades de Símbolo-Dígito, Teste de Leitura de Stroop Word, Batida Rápida Tarefa e MoCA. Os resultados dessas avaliações foram usados para calcular três escores z compostos de cognição - escore z composto principal, escore z composto exploratório e escore z de função executiva.
PBT2 mostrou sinais de melhorar alguns aspectos da função cognitiva no estudo. A dose de 250 mg de PBT2, administrada uma vez ao dia, mostrou eficácia melhor e estatisticamente significativa durante o período de tratamento de 12 semanas em comparação com o placebo para o escore de cognição composto principal (p = 0,020), escore z de cognição composta exploratória (p = 0,016) , Escore Z composto de Função Executiva (p = 0,005) e TMT Parte B (p <0,001), uma ferramenta de avaliação cognitiva. Em 26 semanas, TMT Parte B foi estatisticamente significativamente melhorado (p = 0,042) e o escore z composto de Função Executiva tendendo a melhorar. Em pacientes com HD inicial (Capacidade Funcional Total 11-13), o escore z composto da Função Executiva foi estatisticamente significativamente melhorado (p = 0,038).
No geral, os resultados indicam que estudos maiores são necessários para avaliar completamente o perfil de segurança e eficácia de PBT2 em AD e HD.
Outras aplicações
O PBT2 foi aplicado ao tratamento de bactérias multirresistentes . Em combinação com zinco, o ionóforo de zinco PBT2 demonstrou reverter a resistência aos antibióticos para uma série de patógenos bacterianos clinicamente significativos, incluindo MRSA, GAS e VRE, tanto in vitro quanto em um modelo de infecção em camundongo.
