Fases do flúor - Phases of fluorine
O flúor forma moléculas diatômicas ( F
2 ) que são gasosos à temperatura ambiente com uma densidade cerca de 1,3 vezes a do ar. Embora às vezes citado como verde-amarelo, o gás flúor puro é, na verdade, um amarelo muito claro. A cor só pode ser observada no gás flúor concentrado ao olhar para baixo no eixo dos tubos longos, pois parece transparente quando observada lateralmente em tubos normais ou se for liberado para a atmosfera. O elemento tem um odor característico "pungente" que é perceptível em concentrações tão baixas quanto 20 ppb .

O flúor se condensa em um líquido amarelo brilhante a −188 ° C (−307 ° F), que está próximo das temperaturas de condensação de oxigênio e nitrogênio.
O estado sólido do flúor depende das forças de Van der Waals para manter as moléculas unidas, que, devido ao pequeno tamanho das moléculas de flúor , são relativamente fracas. Conseqüentemente, o estado sólido do flúor é mais semelhante ao do oxigênio ou dos gases nobres do que ao dos halogênios mais pesados.
O flúor se solidifica a -220 ° C (-363 ° F) em uma estrutura cúbica , chamada beta-flúor. Esta fase é transparente e suave, com desordem significativa das moléculas; sua densidade é 1,70 g / cm 3 . A −228 ° C (−378 ° F), o flúor sofre uma transição de fase sólido-sólido para uma estrutura monoclínica chamada alfa-flúor. Esta fase é opaca e dura, com camadas compactadas de moléculas, e é mais densa a 1,97 g / cm 3 . A mudança de fase de estado sólido requer mais energia do que a transição do ponto de fusão e pode ser violenta, estilhaçando amostras e estourando as janelas do porta-amostras.
O flúor sólido recebeu estudos significativos nas décadas de 1920 e 30, mas relativamente menos até os anos 1960. A estrutura cristalina do alfa-flúor fornecida, que ainda apresenta alguma incerteza, data de um artigo de 1970 de Linus Pauling .
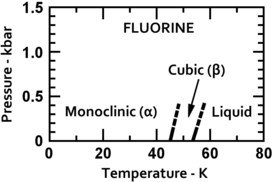
|

|
| Fases de flúor de baixa temperatura | Estrutura de cristal alfa-flúor |
Notas
Citações
Referências indexadas
- Dean, John A. (1999). Manual de química de Lange (15ª ed.). McGraw-Hill, Inc. ISBN 0-07-016190-9 .
-
Ullmann, Franz, ed. (2005). Enciclopédia de Química Industrial . Wiley-VCH . ISBN 978-3-527-30673-2 .
- Jaccaud, Michael; Faron, Robert; Devilliers, Didier; Romano, René (2000). "Flúor". Enciclopédia de Química Industrial de Ullmann . doi : 10.1002 / 14356007.a11_293 . ISBN 3527306730 .
Leitura adicional
- Jordan, TH; Streib, WE; Lipscomb, WN (1964). "Single-Crystal X-Ray Diffraction Study of β-Fluorine". The Journal of Chemical Physics . 41 (3): 760. Bibcode : 1964JChPh..41..760J . doi : 10.1063 / 1.1725957 .
- Jordan, TH; Streib, WD; Smith, HW; Lipscomb, WN (1964). "Estudos de cristal único de β-F2 e de γ-O2". Acta Crystallographica . 17 (6): 777. doi : 10.1107 / S0365110X6400202X .
- Meyer, L. (1968). "Crystal Structure of α-Fluorine". The Journal of Chemical Physics . 49 (4): 1902–1907. Bibcode : 1968JChPh..49.1902M . doi : 10.1063 / 1.1670323 .
- Pauling, L .; Keaveny, I .; Robinson, AB (1970). "The Crystal Structure of α-Fluorine". Journal of Solid State Chemistry . 2 (2): 225–227. Bibcode : 1970JSSCh ... 2..225P . doi : 10.1016 / 0022-4596 (70) 90074-5 .
- Etters, RD; Kirin, D. (1986). "Comportamento de alta pressão do flúor molecular sólido em baixas temperaturas". The Journal of Physical Chemistry . 90 (19): 4670. doi : 10.1021 / j100410a041 .
- Kobashi, K .; Klein, ML (1980). "Vibrações reticuladas de α-F2 sólido". Física Molecular . 41 (3): 679. bibcode : 1980MolPh..41..679K . doi : 10.1080 / 00268978000103071 .
- Inglês, CA; Venables, JA (1974). "The Structure of the Diatomic Molecular Solids". Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences . 340 (1620): 57. bibcode : 1974RSPSA.340 ... 57E . doi : 10.1098 / rspa.1974.0140 .
- http://www.osti.gov/bridge/servlets/purl/4010212-0BbwUC/4010212.pdf (diagramas de fase dos elementos)
- http://jcp.aip.org/resource/1/jcpsa6/v47/i2/p740_s1?isAuthorized=no (explosão de suporte de amostra)
- NASA ADS: sólido flúor e cloro sólido: estruturas cristalinas e forças intermoleculares por SC Nyburg


