Fosfato -Phosphate

|
|||
|
|
|||
| Nomes | |||
|---|---|---|---|
|
Nome IUPAC sistemático
Fosfato |
|||
| Identificadores | |||
|
Modelo 3D ( JSmol )
|
|||
| 3903772 | |||
| ChEBI | |||
| ChemSpider | |||
| 1997 | |||
| Malha | Fosfatos | ||
|
PubChem CID
|
|||
| UNII | |||
|
|||
|
|||
| Propriedades | |||
|
PO3-4 _ |
|||
| Massa molar | 94,9714 g mol- 1 | ||
| Ácido conjugado | Fosfato de monohidrogênio | ||
|
Exceto quando indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 °C [77 °F], 100 kPa).
|
|||
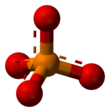
Em química , um fosfato é um ânion , sal , grupo funcional ou éster derivado de um ácido fosfórico . Mais comumente significa ortofosfato , um derivado do ácido ortofosfórico H
3PO
4.
O íon fosfato ou ortofosfato [PO
4]3−
é derivado do ácido fosfórico pela remoção de três prótons H+
. A remoção de um ou dois prótons dá o íon di- hidrogenofosfato [H
2PO
4]−
e o íon hidrogenofosfato [HPO
4]2−
íon, respectivamente. Esses nomes também são usados para sais desses ânions, como di- hidrogenofosfato de amônio e fosfato trissódico .
Em química orgânica , fosfato ou ortofosfato é um organofosforado , um éster de ácido ortofosfórico na forma PO
4RR′R″ onde um ou mais átomos de hidrogênio são substituídos por grupos orgânicos . Um exemplo é o fosfato de trimetilo , (CH
3)
3PO
4. O termo também se refere ao grupo funcional trivalente OP(O-)
3em tais ésteres.
Os ortofosfatos são especialmente importantes entre os vários fosfatos por causa de seus papéis-chave na bioquímica , biogeoquímica e ecologia , e sua importância econômica para a agricultura e a indústria. A adição e remoção de grupos fosfato ( fosforilação e desfosforilação ) são etapas fundamentais no metabolismo celular .
Os ortofosfatos podem condensar para formar pirofosfatos .
Propriedades quimicas
O íon fosfato tem uma massa molar de 94,97 g/mol e consiste em um átomo central de fósforo cercado por quatro átomos de oxigênio em um arranjo tetraédrico . É a base conjugada do íon hidrogenofosfato H(PO
4)2−
, que por sua vez é a base conjugada do íon di-hidrogenofosfato H
2(PO
4)−
, que por sua vez é a base conjugada do ácido ortofosfórico , H
3PO
4.
Muitos fosfatos são solúveis em água à temperatura e pressão padrão . Os fosfatos de sódio, potássio, rubídio , césio e amônio são todos solúveis em água. A maioria dos outros fosfatos são apenas ligeiramente solúveis ou insolúveis em água. Como regra, os fosfatos de hidrogênio e di-hidrogênio são ligeiramente mais solúveis que os fosfatos correspondentes.
Equilíbrio em solução
Em solução aquosa, o ácido ortofosfórico e seus três ânions derivados coexistem de acordo com os equilíbrios de dissociação e recombinação abaixo
| Equilíbrio | Constante de dissociação K a | p K a |
|---|---|---|
| H 3 PO 4 ⇌ H 2PO- 4+ H+ |
K a 1 = [ H+ ] [ H 2PO- 4] / [ H 3PO 4] ≈ 7,5 × 10 −3 |
pKa1 = 2,14 _ |
|
H 2PO- 4⇌ HPO2-4 _+ H+ |
K a 2 = [ H+ ] [ HPO2-4 _] / [ H 2PO- 4] ≈ 6,2 × 10 −8 |
pKa2 = 7,20 _ |
|
HPO2-4 _⇌ PO3-4 _+ H+ |
K a 3 = [ H+ ] [ PO3-4 _] / [ HPO2-4 _] ≈ 2,14 × 10 −13 |
pKa3 = 12,37 _ |
Os valores são a 25 °C e 0 força iônica.
Os valores de p K a são os valores de pH onde a concentração de cada espécie é igual à de suas bases conjugadas . A pH 1 ou inferior, o ácido fosfórico é praticamente indissociado. Em torno de pH 4,7 (a meio caminho entre os dois primeiros valores de p K a ) o íon di-hidrogenofosfato, [H
2PO
4]−
, é praticamente a única espécie presente. Por volta de pH 9,8 (a meio caminho entre o segundo e o terceiro valores de p K a ) o íon mono-hidrogenofosfato, [HPO
4]2−
, é a única espécie presente. Em pH 13 ou superior, o ácido é completamente dissociado como o íon fosfato, (PO
4)3−
.
Isto significa que os sais dos iões mono- e di-fosfato podem ser cristalizados selectivamente a partir de uma solução aquosa definindo o valor de pH para 4,7 ou 9,8.
Com efeito, H.
3PO
4, H
2(PO
4)−
e H(PO
4)2−
comportam-se como ácidos fracos separados porque os sucessivos p K a diferem em mais de 4.
O fosfato pode formar muitos íons poliméricos , como pirofosfato , (P
2O
7)4−
, e trifosfato , (P
3O
10)5−
. Os vários íons metafosfato (que geralmente são polímeros lineares longos) têm uma fórmula empírica de (PO
3)−
e são encontrados em muitos compostos.
Bioquímica de fosfatos
Em sistemas biológicos , o fósforo pode ser encontrado como ânions de fosfato livres em solução ( fosfato inorgânico ) ou ligado a moléculas orgânicas como vários organofosforados .
O fosfato inorgânico é geralmente denotado por Pi e em pH fisiológico (homeostático) consiste principalmente de uma mistura de [HPO
4]2−
e [H
2PO
4]−
íons. Em um pH neutro, como no citosol (pH = 7,0), as concentrações do ácido ortofosfórico e seus três ânions têm as proporções
- [ H
2PO-
4] / [ H
3PO
4] ≈ 7,5 × 10 4 - [ HPO2-4
_] / [ H
2PO-
4] ≈ 0,62 - [ PO3-4
_] / [ HPO2-4
_] ≈ 2,14 × 10 −6
Assim, apenas [H
2PO
4]−
e [HPO
4]2−
íons estão presentes em quantidades significativas no citosol (62% [H
2PO
4]−
, 38% [HPO
4]2−
). No líquido extracelular (pH = 7,4), essa proporção é invertida (61% [HPO
4]2−
, 39% [H
2PO
4]−
).
O fosfato inorgânico pode estar presente também como ânions pirofosfato [P
2O
7]4−
, que pode dar ortofosfato por hidrólise :
-
[P
2O
7]4−
+ H 2 O ⇌ 2 [HPO
4]2−
Os fosfatos orgânicos são comumente encontrados na forma de ésteres como nucleotídeos (por exemplo , AMP , ADP e ATP ) e em DNA e RNA . Os ânions ortofosfato livres podem ser liberados pela hidrólise das ligações fosfoanidrido em ATP ou ADP. Essas reações de fosforilação e desfosforilação são o armazenamento imediato e a fonte de energia para muitos processos metabólicos . ATP e ADP são muitas vezes referidos como fosfatos de alta energia , assim como os fosfagênios no tecido muscular. Reações semelhantes existem para os outros difosfatos e trifosfatos de nucleosídeos .
Ossos e dentes
Uma ocorrência importante de fosfatos em sistemas biológicos é como material estrutural de ossos e dentes. Essas estruturas são feitas de fosfato de cálcio cristalino na forma de hidroxiapatita . O esmalte duro e denso dos dentes de mamíferos pode conter fluoroapatita , um hidroxifosfato de cálcio onde alguns dos grupos hidroxila foram substituídos por íons de fluoreto .
Usos em pesquisas médicas e biológicas
O tipo medicinal (sal) de fósforo é o fosfato. Alguns fosfatos, que ajudam a curar muitas infecções do trato urinário, são usados para tornar a urina mais ácida. Para evitar o desenvolvimento de cálculos de cálcio no trato urinário, alguns fosfatos são usados. Para pacientes que não conseguem obter fósforo suficiente em sua dieta diária, os fosfatos são usados como suplementos alimentares, geralmente devido a certos distúrbios ou doenças. Os fosfatos injetáveis só podem ser manuseados por um profissional de saúde.
Metabolismo da planta
As plantas absorvem fósforo através de várias vias: a via micorrízica arbuscular e a via de absorção direta.
Efeitos adversos à saúde
A hiperfosfatemia , ou um alto nível de fosfatos no sangue, está associada a mortalidade elevada na população em geral. A hiperfosfatemia é geralmente causada por aditivos alimentares de fosfato , pois os fosfatos que estão naturalmente presentes nos alimentos não são completamente absorvidos pelo trato gastrointestinal . Fosfatos induzem calcificação vascular , e uma alta concentração de fosfatos no sangue foi considerada um preditor de eventos cardiovasculares .
Os fosfatos são comumente usados como aditivos em alimentos processados industrialmente e fast food . Fast food e alimentos processados prontos para consumo são os principais contribuintes para o aumento do consumo de fosfato entre a população. Aditivos de fosfatos também são comumente encontrados em refrigerantes com sabor , bem como em certos produtos lácteos .
Produção
Ocorrência geológica


Os fosfatos são a forma natural do elemento fósforo , encontrado em muitos minerais de fosfato . Em mineralogia e geologia, fosfato refere-se a uma rocha ou minério contendo íons de fosfato. Os fosfatos inorgânicos são extraídos para obter fósforo para uso na agricultura e na indústria.
O maior produtor e exportador mundial de fosfatos é o Marrocos . Dentro da América do Norte, os maiores depósitos estão na região de Bone Valley , no centro da Flórida , na região de Soda Springs , no sudeste de Idaho , e na costa da Carolina do Norte . Depósitos menores estão localizados em Montana , Tennessee , Geórgia e Carolina do Sul . A pequena nação insular de Nauru e sua vizinha Ilha de Banaba , que costumava ter enormes depósitos de fosfato da melhor qualidade, foram minadas excessivamente. O fosfato de rocha também pode ser encontrado no Egito, Israel, Palestina, Saara Ocidental, Ilha Navassa , Tunísia, Togo e Jordânia, países que possuem grandes indústrias de mineração de fosfato.
As minas de fosforita são encontradas principalmente em:
- América do Norte :Estados Unidos, especialmente Flórida, com depósitos menores na Carolina do Norte , Idaho e Tennessee
- África : Marrocos , Argélia , Egito , Níger , Senegal , Togo , Tunísia .
- Oriente Médio : Israel , Arábia Saudita , Jordânia , Síria , Irã e Iraque , na cidade de Akashat , próximo à fronteira com a Jordânia.
- Ásia Central : Cazaquistão
- Oceania : Austrália , Makatea , Nauru e Ilha Banaba
Em 2007, no ritmo atual de consumo, estimava-se que a oferta de fósforo se esgotaria em 345 anos. No entanto, alguns cientistas pensaram que um “ pico de fósforo ” ocorreria em 30 anos e Dana Cordell, do Institute for Sustainable Futures, disse que “nas taxas atuais, as reservas serão esgotadas nos próximos 50 a 100 anos”. As reservas referem-se ao montante assumido como recuperável a preços correntes de mercado. Em 2012, o USGS estimou as reservas mundiais em 71 bilhões de toneladas, enquanto 0,19 bilhão de toneladas foram extraídas globalmente em 2011. O fósforo compreende 0,1% em massa da rocha média (enquanto, para perspectiva, sua concentração típica na vegetação é de 0,03% a 0,2%) , e consequentemente há quatrilhões de toneladas de fósforo na crosta terrestre de 3×10 19 toneladas, embora em concentração predominantemente menor do que os depósitos contabilizados como reservas, que são inventariados e mais baratos de extrair. Se for assumido que os minerais de fosfato na rocha fosfática são principalmente hidroxiapatita e fluoroapatita, os minerais de fosfato contêm aproximadamente 18,5% de fósforo em peso. Se a rocha fosfática contém cerca de 20% desses minerais, a rocha fosfática média tem aproximadamente 3,7% de fósforo em peso.
Alguns depósitos de rocha fosfática, como Mulberry na Flórida, são notáveis pela inclusão de quantidades significativas de isótopos de urânio radioativos. Isso é uma preocupação porque a radioatividade pode ser liberada nas águas superficiais a partir da aplicação do fertilizante fosfatado resultante .
Em dezembro de 2012, a Cominco Resources anunciou um recurso atualizado em conformidade com JORC de seu projeto Hinda no Congo-Brazzaville de 531 milhões de toneladas, tornando-o o maior depósito de fosfato medido e indicado no mundo.
Mineração
Os três principais países produtores de fosfato (China, Marrocos e Estados Unidos) respondem por cerca de 70% da produção mundial.
| País | Produção (milhões de kg) |
Participação da produção global (%) |
Reservas (milhões de kg) |
|---|---|---|---|
| Argélia | 1.300 | 0,54 | 2.200.000 |
| Austrália | 2.700 | 1,17 | 1.100.000 |
| Brasil | 4.700 | 3,00 | 1.600.000 |
| China | 95.000 | 44,83 | 3.200.000 |
| Egito | 5.000 | 2,47 | 2.800.000 |
| Finlândia | 995 | - | 1.000.000 |
| Índia | 1.480 | 0,49 | 46.000 |
| Iraque | 200 | 0,09 | 430.000 |
| Israel | 2.810 | 1,48 | 57.000 |
| Jordânia | 9.220 | 3,36 | 800.000 |
| Cazaquistão | 1.500 | 0,72 | 260.000 |
| México | 558 | 0,76 | 30.000 |
| Marrocos e Saara Ocidental | 35.500 | 13h45 | 50.000.000 |
| Peru | 4.000 | 1,79 | 210.000 |
| Rússia | 13.100 | 5,60 | 600.000 |
| Arábia Saudita | 6.500 | 1,48 | 1.400.000 |
| Senegal | 3.420 | 0,45 | 50.000 |
| África do Sul | 2.100 | 0,99 | 1.400.000 |
| Síria | 2.000 | 0,34 | 1.800.000 |
| Ir | 800 | 0,45 | 30.000 |
| Tunísia | 4.110 | 1,79 | 100.000 |
| Uzbequistão | 900 | - | 100.000 |
| Estados Unidos | 23.300 | 12,37 | 1.000.000 |
| Vietnã | 4.650 | 1,21 | 30.000 |
| Outros países | 1.140 | 1,17 | 840.000 |
| Total | 227.000 | 100 | 71.000.000 |
Ecologia


Em termos ecológicos, devido ao seu importante papel nos sistemas biológicos, o fosfato é um recurso muito procurado. Uma vez utilizado, muitas vezes é um nutriente limitante nos ambientes , e sua disponibilidade pode governar a taxa de crescimento dos organismos. Isso geralmente é verdade para ambientes de água doce , enquanto o nitrogênio é mais frequentemente o nutriente limitante em ambientes marinhos (água do mar). A adição de altos níveis de fosfato em ambientes e microambientes em que é tipicamente raro pode ter consequências ecológicas significativas. Por exemplo, podem ocorrer florescimentos nas populações de alguns organismos às custas de outros, e o colapso de populações privadas de recursos como oxigênio (veja eutrofização ). No contexto da poluição, os fosfatos são um componente dos sólidos totais dissolvidos , um importante indicador da qualidade da água, mas nem todo fósforo está em uma forma molecular que as algas podem decompor e consumir.
Hidroxiapatita de cálcio e precipitados de calcita podem ser encontrados ao redor de bactérias no solo aluvial . Como os argilominerais promovem a biomineralização, a presença de bactérias e argilominerais resultou em precipitados de hidroxiapatita de cálcio e calcita.
Os depósitos de fosfato podem conter quantidades significativas de metais pesados que ocorrem naturalmente. As operações de mineração que processam rocha fosfática podem deixar pilhas de rejeitos contendo níveis elevados de cádmio , chumbo , níquel , cobre , cromo e urânio . A menos que sejam cuidadosamente gerenciados, esses produtos residuais podem lixiviar metais pesados em águas subterrâneas ou estuários próximos. A absorção dessas substâncias pelas plantas e pela vida marinha pode levar à concentração de metais pesados tóxicos em produtos alimentícios.
Veja também
-
Pirofosfato – (P
2O
7)4−
-
Polifosfato – (HPO
3)
n -
Metafosfato – (POn
3) - Fertilizante
-
Hipofosfito – H
2(PO
2)−
- Compostos organofosforados
- Fosfato – OP(OR) 3 , como trifenil fosfato
- Revestimento de conversão de fosfato
- Soda de fosfato , uma bebida de fonte de refrigerante
- Fosfinato – OP(OR)R 2
- Fosfina – PR 3
- Óxido de fosfina – OPR 3
- Fosfinita – P(OR)R 2
- Fosfito – P(OR) 3
- Fosfogesso
- Fosfonato – OP(OR) 2 R
- Fosfonita – P(OR) 2 R
- Fosforilação
- Fosfato de diamônio - (NH 4 ) 2 HPO 4
- Fosfato dissódico – Na 2 HPO 4
- Fosfato monossódico – NaH 2 PO 4
- Tripolifosfato de sódio – Na 5 P 3 O 10
- Bacia Ouled Abdoun
Referências
links externos
- O US Minerals Databrowser fornece gráficos de dados que abrangem consumo, produção, importações, exportações e preços de fosfato e 86 outros minerais
- Fosfato: monografia analyte - The Association for Clinical Biochemistry and Laboratory Medicine