Sesquisulfeto de fósforo - Phosphorus sesquisulfide
|
|
|||

|
|||
| Nomes | |||
|---|---|---|---|
|
Nomes IUPAC
Trissulfeto de tetrafosforo
ou 3,5,7-tritia-1,2,4,6-tetrafosfatriciclo [2.2.1.0 2,6 ] heptano |
|||
| Outros nomes
trissulfeto de fósforo, sesquisulfeto de fósforo, sulfeto de fósforo
|
|||
| Identificadores | |||
|
Modelo 3D ( JSmol )
|
|||
| ChemSpider | |||
| ECHA InfoCard |
100.013.860 |
||
|
PubChem CID
|
|||
| Número RTECS | |||
| UNII | |||
|
Painel CompTox ( EPA )
|
|||
|
|||
|
|||
| Propriedades | |||
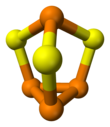
| P 4 S 3 | |||
| Massa molar | 220,093 g / mol | ||
| Aparência | Sólido amarelo, verde-amarelo ou cinza | ||
| Densidade | 2,08 g.cm 3 , sólido | ||
| Ponto de fusão | 172,5 ° C (342,5 ° F; 445,6 K) | ||
| Ponto de ebulição | 408 ° C (766 ° F; 681 K) | ||
| Estrutura | |||
| ortorrômbico , notação Schönflies D 2h | |||
| Pmnb | |||
| C 3v | |||
| Compostos relacionados | |||
|
Compostos relacionados
|
P 4 S 10 P 4 O 6 |
||
| Perigos | |||
| Riscos principais | Irritante | ||
| Pictogramas GHS |

|
||
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|||
|
|
|||
| Referências da Infobox | |||
O sesquisulfeto de fósforo é o composto inorgânico com a fórmula P 4 S 3 . Foi desenvolvido por Henri Sevene e Emile David Cahen em 1898 como parte de sua invenção de fósforos de fricção que não representavam os perigos do fósforo branco para a saúde . Este sólido amarelo é um dos dois sulfetos de fósforo produzidos comercialmente . É um componente de partidas do tipo "atacar em qualquer lugar".
Dependendo da pureza, as amostras podem aparecer amarelo esverdeado a cinza. O composto foi descoberto por G. Lemoine e produzido com segurança em quantidades comerciais em 1898 por Albright e Wilson . Ele se dissolve em um peso igual de dissulfeto de carbono (CS 2 ), e em uma proporção de 1:50 em peso de benzeno . Ao contrário de alguns outros sulfetos de fósforo, P 4 S 3 é lento para hidrolisar e tem um ponto de fusão bem definido.
Estrutura e síntese
A molécula tem simetria C 3v . É um derivado da unidade tetraédrica (P 4 ) da inserção do enxofre em três ligações PP. As distâncias PS e PP são 2,090 e 2,235 Å, respectivamente. P 4 Se 3 e P 4 S 3 adotam as mesmas estruturas. Esses compostos podem ser fundidos juntos e formar cristais mistos de um dissolvido no outro. Sob temperaturas mais altas, as moléculas de calcogeneto mistas P 4 S 2 Se e P 4 SSe 2 se formarão.
P 4 S 3 é produzido pela reação do fósforo vermelho ou branco com o enxofre. O excesso de enxofre dá pentassulfeto de fósforo (P 4 S 10 ). Estima-se que 150 ton / ano foram produzidas em 1989.
Formulários
O P 4 S 3 e o clorato de potássio , em conjunto com outros materiais, compõem as cabeças dos " fósforos de ataque em qualquer lugar ".
Segurança
Seu ponto de fulgor é de cerca de 100 ° C.
Efeitos na saúde
A exposição a fósforos do tipo "acertar em qualquer lugar" contendo sesquisulfeto de fósforo pode causar dermatite de contato , geralmente na área da bolsa, mas também no rosto. A exposição por um longo período de tempo a pontas de fósforos em chamas (contendo sesquisulfeto de fósforo) pode resultar em dermatite primária grave recorrente nos olhos e no rosto. O afrouxamento dos dentes também foi relatado, o que pode ser devido ao envenenamento por fósforo.
Referências
Este artigo contém texto de domínio público da NOAA conforme citado.