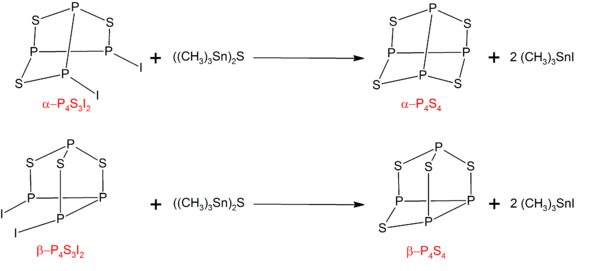Sulfeto de fósforo - Phosphorus sulfide
Os sulfetos de fósforo compreendem uma família de compostos inorgânicos contendo apenas fósforo e enxofre . Esses compostos têm a fórmula P 4 S x com x ≤ 10. Dois são de importância comercial, pentassulfeto de fósforo (P 4 S 10 ), que é feito em uma escala de quilotons para a produção de outros compostos organossulfurados, e sesquisulfeto de fósforo (P 4 S 3 ), usado na produção de "fósforos em qualquer lugar" .
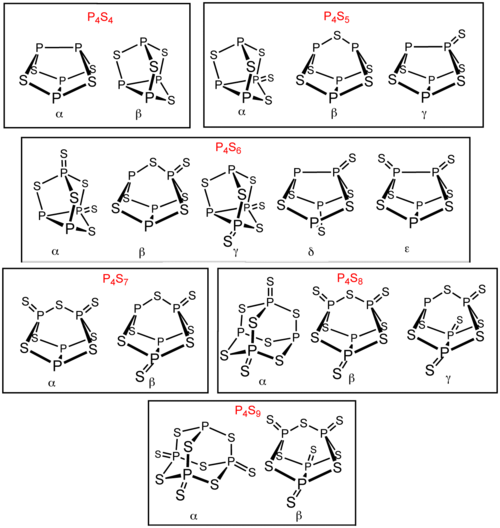
Existem vários outros sulfetos de fósforo além de P 4 S 3 e P 4 S 10 . Seis desses sulfetos de fósforo existem como isômeros : P 4 S 4 , P 4 S 5 , P 4 S 6 , P 4 S 7 , P 4 S 8 e P 4 S 9 . Esses isômeros são diferenciados por prefixos de letras gregas. O prefixo é baseado na ordem de descoberta dos isômeros, não em sua estrutura. Todos os sulfetos de fósforo moleculares conhecidos contêm uma matriz tetraédrica de quatro átomos de fósforo. P 4 S 2 também é conhecido, mas é instável acima de −30 ° C.
Preparação
O principal método de preparação desses compostos é a termólise de misturas de fósforo e enxofre. As distribuições de produto pode ser analisada por 31 P RMN espectroscopia . Sínteses mais seletivas envolvem (i) dessulfurização, por exemplo, usando trifenilfosfina e, complementarmente, (ii) sulfetação usando sulfeto de trifenilarsina .
P 4 S 3
O sesquisulfeto de fósforo é preparado tratando o fósforo vermelho com enxofre acima de 450 K, seguido por uma recristalização cuidadosa com dissulfeto de carbono e benzeno . Um método alternativo envolve a fusão controlada de fósforo branco com enxofre em um solvente inerte e não inflamável.
P 4 S 4
As formas α- e β- de P 4 S 4 podem ser preparadas tratando os isômeros correspondentes de P 4 S 3 I 2 com ((CH 3 ) 3 Sn) 2 S:
P 4 S 3 I 2 pode ser sintetizado pela reação de quantidades estequiométricas de fósforo, enxofre e iodo.
P 4 S 5
P 4 S 5 pode ser preparado tratando quantidades estequiométricas de P 4 S 3 com enxofre em solução de dissulfeto de carbono, na presença de luz e uma quantidade catalítica de iodo . A distribuição do produto respectivo é então analisado utilizando 31 P RMN espectroscopia .
Em particular, α-P 4 S 5 pode ser facilmente produzido pela reação fotoquímica de P 4 S 10 com fósforo vermelho. Observe que P 4 S 5 é instável quando aquecido, tendendo a se desproporcional a P 4 S 3 e P 4 S 7 antes de atingir seu ponto de fusão.
P 4 S 6
P 4 S 6 pode ser feito abstraindo um átomo de enxofre de P 4 S 7 usando trifenilfosfina :
O tratamento de α-P 4 S 5 com Ph 3 AsS em CS 2 também produz α-P 4 S 6 . Os dois novos polimorfos δ-P 4 S 6 e ε-P 4 S 6 podem ser feitos tratando α-P 4 S 4 com Ph 3 SbS em CS 2 .
P 4 S 7
P 4 S 7 é mais convenientemente feito pela união direta dos elementos correspondentes, e é um dos sulfetos de fósforo binários mais facilmente purificados.
- P 4 + 7 S → P 4 S 7
P 4 S 8
β-P 4 S 8 pode ser feito tratando α-P 4 S 7 com Ph 3 AsS em CS 2 , que produz uma mistura entre α-P 4 S 7 e β-P 4 S 8 .
P 4 S 9
P 4 S 9 pode ser feito por dois métodos. Um método envolve o aquecimento de P 4 S 3 em excesso de enxofre. Outro método envolve o aquecimento de P 4 S 7 e P 4 S 10 na razão molar de 1: 2, onde P 4 S 9 é formado reversivelmente:
- P 4 S 7 + 2 P 4 S 10 ⇌ 3 P 4 S 9
P 4 S 10
P 4 S 10 é um dos sulfetos de fósforo mais estáveis. É mais facilmente feito aquecendo fósforo branco com enxofre acima de 570 K em um tubo evacuado.
- P 4 + 10 S → P 4 S 10
Referências
- ^ Jason, ME; Ngo, T .; Rahman, S. (1997). "Produtos e mecanismos na oxidação do fósforo pelo enxofre a baixa temperatura". Inorg. Chem. 36 (12): 2633–2640. doi : 10.1021 / ic9614879 .
- ^ Holleman, AF; Wiberg, E. Inorganic Chemistry . Academic Press: San Diego, 2001. ISBN 0-12-352651-5 .
- ^ Cure, HG A química heterocíclica inorgânica do enxofre, do nitrogênio e do fósforo Academic Press: London; 1980 ISBN 0-12-335680-6 .
- ^ a b c Jason, ME (1997). "Transferência de enxofre de sulfetos de arsênio e antimônio para sulfetos de fósforo. Síntese racional de várias espécies menos comuns de P 4 S n ". Inorg. Chem. 36 (12): 2641–2646. doi : 10.1021 / ic9614881 .
- ^ Nowottnick, H .; Blachnik, R. (1999). "Zwei neue Phosphorsulfide (Two New Phosphorus Sulfides)". Zeitschrift für anorganische und allgemeine Chemie . 625 (12): 1966–1968. doi : 10.1002 / (SICI) 1521-3749 (199912) 625: 12 <1966 :: AID-ZAAC1966> 3.0.CO; 2-B .
- ^ a b c d e Catherine E. Housecroft; Alan G. Sharpe (2008). "Capítulo 15: Os elementos do grupo 15". Química Inorgânica, 3ª Edição . Pearson. p. 484. ISBN 978-0-13-175553-6.
- ^ "Phosphorus trisulfide" em Handbook of Preparative Inorganic Chemistry, 2a Ed. Editado por G. Brauer, Academic Press, 1963, NY. Vol. 1. p. 563.
- ^ "Phosphorus pentasulfide" em Handbook of Preparative Inorganic Chemistry, 2a Ed. Editado por G. Brauer, Academic Press, 1963, NY. Vol. 1. p. 565.
- ^ A. Earnshaw; Norman Greenwood (2002). "Fósforo". Química dos elementos, 2ª edição . Butterworth Heinemann. p. 508. ISBN 0750633654.
- ^ a b R. Bruce King (2005). "Fósforo". Enciclopédia de Química Inorgânica, 2ª edição . Wiley. p. 3711. ISBN 9780470862100.
- ^ "Phosphorus heptasulfide" em Handbook of Preparative Inorganic Chemistry, 2a Ed. Editado por G. Brauer, Academic Press, 1963, NY. Vol. 1. p. 566.
- ^ "Diphosphorus pentasulfide" em Handbook of Preparative Inorganic Chemistry, 2a Ed. Editado por G. Brauer, Academic Press, 1963, NY. Vol. 1. p. 567.