Química Físico-Orgânica - Physical organic chemistry
Química física orgânica , termo cunhado por Louis Hammett em 1940, refere-se a uma disciplina de química orgânica que se concentra na relação entre estruturas químicas e reatividade , em particular, aplicando ferramentas experimentais de físico-química ao estudo de moléculas orgânicas . Pontos focais específicos de estudo incluem as taxas de reações orgânicas , as estabilidades químicas relativas dos materiais de partida, intermediários reativos , estados de transição e produtos de reações químicas e aspectos não covalentes de solvatação e interações moleculares que influenciam a reatividade química. Tais estudos fornecem arcabouços teóricos e práticos para entender como as mudanças na estrutura em soluções ou contextos de estado sólido impactam o mecanismo de reação e a taxa para cada reação orgânica de interesse.
Aplicativo
Químicos físicos orgânicos usam abordagens teóricas e experimentais para entender esses problemas fundamentais em química orgânica , incluindo cálculos termodinâmicos clássicos e estatísticos , teoria mecânica quântica e química computacional , bem como espectroscopia experimental (por exemplo, NMR ), espectrometria (por exemplo, MS ), e abordagens de cristalografia . O campo, portanto, tem aplicações para uma ampla variedade de campos mais especializados, incluindo eletroquímica e fotoquímica , química de polímeros e supramolecular e química bioorgânica , enzimologia e biologia química , bem como para empresas comerciais envolvendo química de processos , engenharia química , ciência de materiais e nanotecnologia e farmacologia na descoberta de medicamentos por design.
Alcance
A química física orgânica é o estudo da relação entre a estrutura e a reatividade das moléculas orgânicas . Mais especificamente, a físico-química orgânica aplica as ferramentas experimentais da físico-química ao estudo da estrutura das moléculas orgânicas e fornece uma estrutura teórica que interpreta como a estrutura influencia os mecanismos e as taxas das reações orgânicas . Pode ser considerado um subcampo que faz a ponte entre a química orgânica e a físico-química .
Químicos físicos orgânicos usam disciplinas experimentais e teóricas, como espectroscopia , espectrometria , cristalografia , química computacional e teoria quântica para estudar as taxas de reações orgânicas e a estabilidade química relativa dos materiais iniciais, estados de transição e produtos. Os químicos neste campo trabalham para compreender os fundamentos físicos da química orgânica moderna e, portanto, a química orgânica física tem aplicações em áreas especializadas, incluindo química de polímeros , química supramolecular , eletroquímica e fotoquímica .
História
O próprio termo físico-química orgânica foi cunhado por Louis Hammett em 1940, quando ele usou a frase como título para seu livro.
Estrutura química e termodinâmica
Termoquímica
Os químicos orgânicos usam as ferramentas da termodinâmica para estudar a ligação , a estabilidade e a energética dos sistemas químicos. Isso inclui experimentos para medir ou determinar a entalpia (ΔH), entropia (ΔS) e energia livre de Gibbs (ΔG) de uma reação, transformação ou isomerização. Os químicos podem usar várias análises químicas e matemáticas, como um gráfico de Van 't Hoff , para calcular esses valores.
Constantes empíricas, como energia de dissociação de ligação , calor padrão de formação (ΔH f °) e calor de combustão (ΔH c °) são usados para prever a estabilidade das moléculas e a mudança na entalpia (ΔH) ao longo das reações. Para moléculas complexas, um valor de ΔH f ° pode não estar disponível, mas pode ser estimado usando fragmentos moleculares com calores de formação conhecidos . Esse tipo de análise é frequentemente referido como teoria do incremento de grupo de Benson , em homenagem ao químico Sidney Benson, que passou uma carreira desenvolvendo o conceito.
A termoquímica de intermediários reativos - carbocations , carbânions e radicais - também é de interesse para os químicos orgânicos físicos. Dados de incremento de grupo estão disponíveis para sistemas radicais. As estabilidades de carbonatação e carbanião podem ser avaliadas usando afinidades de íons hidreto e valores de pK a , respectivamente.
Análise conformacional
Um dos principais métodos para avaliar a estabilidade química e energética é a análise conformacional . Químicos físicos orgânicos usam a análise conformacional para avaliar os vários tipos de cepas presentes em uma molécula para prever produtos de reação. A estirpe pode ser encontrado em ambas as moléculas acíclicos e cíclicos, manifestando-se em sistemas diversos como a tensão de torção , estirpe alílico , tensão de anel , e syn estirpe -pentano . Os valores A fornecem uma base quantitativa para prever a conformação de um ciclohexano substituído , uma importante classe de compostos orgânicos cíclicos cuja reatividade é fortemente guiada por efeitos conformacionais. O valor A é a diferença na energia livre de Gibbs entre as formas axial e equatorial de ciclohexano substituído e, adicionando os valores A de vários substituintes , é possível prever quantitativamente a conformação preferida de um derivado de ciclohexano.
Além da estabilidade molecular, a análise conformacional é usada para prever os produtos da reação. Um exemplo comumente citado do uso de análise conformacional é uma reação de eliminação bi-molecular (E2). Essa reação ocorre mais prontamente quando o nucleófilo ataca a espécie que é antiperiplanar ao grupo de saída. Uma análise orbital molecular desse fenômeno sugere que esta conformação fornece a melhor sobreposição entre os elétrons no orbital de ligação RH σ que está sofrendo ataque nucleofílico e o orbital anti- ligação σ * vazio da ligação RX que está sendo quebrada. Explorando esse efeito, a análise conformacional pode ser usada para projetar moléculas que possuem reatividade aprimorada.
Os processos físicos que dão origem às barreiras de rotação da ligação são complexos, e essas barreiras têm sido extensivamente estudadas por meio de métodos experimentais e teóricos. Vários artigos recentes investigaram a predominância das contribuições estéricas , eletrostáticas e hiperconjugativas para as barreiras rotacionais no etano , butano e outras moléculas substituídas.
Interações não covalentes

Os químicos usam o estudo de ligações / interações não covalentes intramoleculares e intermoleculares em moléculas para avaliar a reatividade. Tais interações incluem, mas não estão limitadas a, ligações de hidrogênio , interações eletrostáticas entre moléculas carregadas, interações dipolo-dipolo , interações polar-π e cátion-π , empilhamento π , química doador-aceitador e ligação de halogênio . Além disso, o efeito hidrofóbico - a associação de compostos orgânicos na água - é uma interação eletrostática não covalente de interesse para os químicos. A origem física precisa do efeito hidrofóbico origina-se de muitas interações complexas , mas acredita-se que seja o componente mais importante do reconhecimento biomolecular na água. Por exemplo, Xu e Melcher et al. elucidou a base estrutural para o reconhecimento do ácido fólico pelas proteínas receptoras de ácido folato. A forte interação entre o ácido fólico e o receptor de folato foi atribuída às ligações de hidrogênio e às interações hidrofóbicas . O estudo de interações não covalentes também é usado para estudar a ligação e a cooperatividade em montagens supramoleculares e compostos macrocíclicos , como éteres de coroa e criptantes , que podem atuar como hospedeiros para moléculas hóspedes.
Química ácido-base

As propriedades dos ácidos e bases são relevantes para a físico-química orgânica. Os químicos orgânicos estão principalmente preocupados com os ácidos / bases de Brønsted-Lowry como doadores / aceitadores de prótons e os ácidos / bases de Lewis como aceitadores / doadores de elétrons em reações orgânicas. Os químicos usam uma série de fatores desenvolvidos a partir da físico-química - eletronegatividade / indução , forças de ligação , ressonância , hibridização , aromaticidade e solvatação - para prever acidez e basicidades relativas.
O princípio ácido / base duro / mole é utilizado para prever as interações moleculares e a direção da reação. Em geral, as interações entre moléculas do mesmo tipo são preferidas. Ou seja, os ácidos duros irão se associar às bases duras e os ácidos moles às bases moles. O conceito de ácidos e bases duros é frequentemente explorado na síntese de complexos de coordenação inorgânicos .
Cinética
Químicos físicos orgânicos usam a base matemática da cinética química para estudar as taxas de reações e os mecanismos de reação. Ao contrário da termodinâmica, que se preocupa com as estabilidades relativas dos produtos e reagentes (ΔG °) e suas concentrações de equilíbrio, o estudo da cinética se concentra na energia livre de ativação (ΔG ‡ ) - a diferença de energia livre entre a estrutura do reagente e a estrutura do estado de transição - de uma reação e, portanto, permite que um químico estude o processo de equilíbrio . Formalismos derivados da matemática, como o postulado de Hammond , o princípio de Curtin-Hammett e a teoria da reversibilidade microscópica, são frequentemente aplicados à química orgânica . Os químicos também usaram o princípio de controle termodinâmico versus controle cinético para influenciar os produtos de reação.
Leis de taxas
O estudo da cinética química é usado para determinar a lei da taxa de uma reação. A lei da taxa fornece uma relação quantitativa entre a taxa de uma reação química e as concentrações ou pressões das espécies químicas presentes. As leis de taxas devem ser determinadas por medição experimental e geralmente não podem ser elucidadas a partir da equação química . A lei da taxa determinada experimentalmente se refere à estequiometria da estrutura do estado de transição em relação à estrutura do estado fundamental. A determinação da lei de taxas era historicamente realizada pelo monitoramento da concentração de um reagente durante uma reação por meio de análise gravimétrica , mas hoje é quase exclusivamente feita por meio de técnicas espectroscópicas rápidas e inequívocas . Na maioria dos casos, a determinação das equações de taxa é simplificada pela adição de um grande excesso ("inundação") de todos os reagentes, exceto um.
Catálise

O estudo da catálise e das reações catalíticas é muito importante para o campo da físico-química orgânica. Um catalisador participa da reação química, mas não é consumido no processo. Um catalisador reduz a barreira de energia de ativação (ΔG ‡ ), aumentando a taxa de uma reação, quer estabilizando a estrutura do estado de transição ou desestabilizando um intermediário de reação chave, e como apenas uma pequena quantidade de catalisador é necessária, ele pode fornecer acesso econômico a ou difícil de sintetizar moléculas orgânicas. Os catalisadores também podem influenciar a taxa de reação, alterando o mecanismo da reação.
Efeito de isótopo cinético
Embora uma lei de taxa forneça a estequiometria da estrutura do estado de transição , ela não fornece nenhuma informação sobre a quebra ou formação de ligações. A substituição de um isótopo próximo a uma posição reativa freqüentemente leva a uma mudança na taxa de uma reação. A substituição isotópica altera a energia potencial dos intermediários de reação e dos estados de transição porque os isótopos mais pesados formam ligações mais fortes com outros átomos. A massa atômica afeta o estado vibracional de ponto zero das moléculas associadas, ligações mais curtas e fortes em moléculas com isótopos mais pesados e ligações mais longas e fracas em moléculas com isótopos leves. Como os movimentos vibracionais freqüentemente mudam durante o curso de uma reação, devido à formação e quebra de ligações, as frequências serão afetadas, e a substituição de um isótopo pode fornecer uma visão sobre o mecanismo de reação e a lei da taxa.
Efeitos substituintes
O estudo de como os substituintes afetam a reatividade de uma molécula ou a taxa de reações é de interesse significativo para os químicos. Os substituintes podem exercer um efeito por meio de interações estéricas e eletrônicas, as últimas das quais incluem ressonância e efeitos indutivos . A polarizabilidade da molécula também pode ser afetada. A maioria dos efeitos dos substituintes são analisados por meio de relações lineares de energia livre (LFERs). O mais comum deles é a análise do gráfico de Hammett . Esta análise compara o efeito de vários substituintes na ionização do ácido benzóico com seu impacto em diversos sistemas químicos. Os parâmetros dos gráficos de Hammett são sigma (σ) e rho (ρ). O valor de σ indica a acidez do ácido benzóico substituído em relação à forma não substituída. Um valor σ positivo indica que o composto é mais ácido, enquanto um valor negativo indica que a versão substituída é menos ácida. O valor de ρ é uma medida da sensibilidade da reação à mudança no substituinte, mas mede apenas os efeitos indutivos. Portanto, foram produzidas duas novas escalas que avaliam a estabilização de cargas localizadas por meio da ressonância. Um é σ + , que se refere a substituintes que estabilizam cargas positivas por ressonância, e o outro é σ - que é para grupos que estabilizam cargas negativas por ressonância. A análise de Hammett pode ser usada para ajudar a elucidar os possíveis mecanismos de uma reação. Por exemplo, se for previsto que a estrutura do estado de transição tem uma acumulação de carga negativa em relação à estrutura do estado fundamental, então espera-se que os grupos doadores de elétrons aumentem a taxa da reação.
Outras escalas LFER foram desenvolvidas. Os efeitos estéricos e polares são analisados por meio dos parâmetros Taft . Mudar o solvente em vez do reagente pode fornecer informações sobre as mudanças na carga durante a reação. O Grunwald-Winstein Plot fornece uma visão quantitativa desses efeitos.
Efeitos do solvente
Os solventes podem ter um efeito poderoso na solubilidade , estabilidade e taxa de reação . Uma mudança no solvente também pode permitir que um químico influencie o controle termodinâmico ou cinético da reação. As reações ocorrem em taxas diferentes em diferentes solventes devido à mudança na distribuição de carga durante uma transformação química. Os efeitos do solvente podem operar nas estruturas do estado fundamental e / ou do estado de transição .
Um exemplo do efeito do solvente nas reações orgânicas é visto na comparação das reações S N 1 e S N 2 .
O solvente também pode ter um efeito significativo no equilíbrio termodinâmico de um sistema, por exemplo, como no caso de tautomerizações ceto-enol . Em apróticos não polares solventes, o enol forma é fortemente favorecida devido à formação de um intramolecular -ligação de hidrogénio , enquanto que no polares apróticos solventes, tais como cloreto de metileno , o enol forma é menos favorecida devido à interacção entre o solvente polar e a dicetona polar . Em solventes próticos , o equilíbrio está na forma cetônica, pois a ligação de hidrogênio intramolecular compete com as ligações de hidrogênio originadas do solvente.
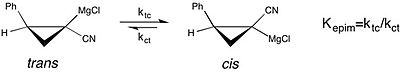
Um exemplo moderno do estudo dos efeitos do solvente no equilíbrio químico pode ser visto em um estudo da epimerização de reagentes de Grignard ciclopropilnitrila quirais . Este estudo relata que a constante de equilíbrio para a isomerização cis para trans do reagente de Grignard é muito maior - a preferência pela forma cis é aumentada - em THF como um solvente de reação, em vez de éter dietílico . No entanto, a taxa mais rápida de isomerização cis-trans em THF resulta em uma perda de pureza estereoquímica . Este é um caso em que entender o efeito do solvente na estabilidade da configuração molecular de um reagente é importante no que diz respeito à seletividade observada em uma síntese assimétrica .
Química Quântica
Muitos aspectos da relação estrutura-reatividade na química orgânica podem ser racionalizados por meio de ressonância , impulso de elétrons, indução , regra dos oito elétrons e hibridização sp , mas esses são apenas formalismos úteis e não representam a realidade física. Devido a essas limitações, uma verdadeira compreensão da química orgânica física requer uma abordagem mais rigorosa baseada na física de partículas . A química quântica fornece um arcabouço teórico rigoroso capaz de prever as propriedades das moléculas por meio do cálculo da estrutura eletrônica de uma molécula e se tornou uma ferramenta prontamente disponível para químicos orgânicos físicos na forma de pacotes de software populares. O poder da química quântica é construído no modelo de onda do átomo , no qual o núcleo é uma esfera muito pequena, carregada positivamente, cercada por uma nuvem de elétrons difusa . As partículas são definidas por sua função de onda associada , uma equação que contém todas as informações associadas a essa partícula. Todas as informações sobre o sistema estão contidas na função de onda. Essas informações são extraídas da função de onda por meio do uso de operadores matemáticos.
A energia associada a uma função de onda particular , talvez a informação mais importante contida em uma função de onda, pode ser extraída resolvendo a equação de Schrödinger (acima, Ψ é a função de onda, E é a energia e Ĥ é o operador hamiltoniano) em que um apropriado O operador hamiltoniano é aplicado. Nas várias formas da equação de Schrödinger, o tamanho total da distribuição de probabilidade de uma partícula aumenta com a diminuição da massa da partícula. Por esse motivo, os núcleos são de tamanho insignificante em relação aos elétrons muito mais leves e são tratados como cargas pontuais em aplicações práticas da química quântica.
Devido às complexas interações que surgem da repulsão elétron-elétron, as soluções algébricas da equação de Schrödinger só são possíveis para sistemas com um elétron, como o átomo de hidrogênio , H 2 + , H 3 2+ , etc .; entretanto, desses modelos simples surgem todos os orbitais atômicos (s, p, d, f) e de ligação (σ, π) familiares . Em sistemas com vários elétrons, uma função de onda multielétron geral descreve todas as suas propriedades de uma vez. Essas funções de onda são geradas por meio da adição linear de funções de onda de um único elétron para gerar uma estimativa inicial, que é modificada repetidamente até que sua energia associada seja minimizada. Muitas vezes, são necessários milhares de palpites até que uma solução satisfatória seja encontrada; portanto, esses cálculos são realizados por computadores poderosos. É importante ressaltar que as soluções para átomos com múltiplos elétrons fornecem propriedades como diâmetro e eletronegatividade que refletem de perto os dados experimentais e os padrões encontrados na tabela periódica . As soluções para moléculas, como o metano , fornecem representações exatas de sua estrutura eletrônica que não podem ser obtidas por métodos experimentais. Em vez de quatro ligações σ discretas do carbono para cada átomo de hidrogênio, a teoria prevê um conjunto de quatro orbitais moleculares de ligação que são deslocalizados em toda a molécula. Da mesma forma, a verdadeira estrutura eletrônica do 1,3-butadieno mostra orbitais moleculares de ligação π deslocalizados que se estendem por toda a molécula, em vez de duas ligações duplas isoladas, conforme previsto por uma estrutura de Lewis simples .
Uma estrutura eletrônica completa oferece grande poder preditivo para transformações orgânicas e dinâmica, especialmente em casos relativos a moléculas aromáticas , sistemas π estendidos , ligações entre íons metálicos e moléculas orgânicas , moléculas contendo heteroátomos não padronizados como selênio e boro , e a dinâmica conformacional de grandes moléculas como como proteínas em que as muitas aproximações em formalismos químicos tornam impossível a previsão de estrutura e reatividade. Um exemplo de como a determinação da estrutura eletrônica é uma ferramenta útil para o químico orgânico físico é a desaromatização do benzeno catalisada por metal . O tricarbonil de cromo é altamente eletrofílico devido à retirada da densidade de elétrons dos orbitais d de cromo preenchidos para os orbitais CO anti - aderentes e é capaz de se ligar covalentemente à face de uma molécula de benzeno por meio de orbitais moleculares deslocalizados . Os ligantes de CO atraem indutivamente a densidade de elétrons do benzeno através do átomo de cromo e ativam dramaticamente o benzeno para o ataque nucleofílico . Os nucleófilos são então capazes de reagir para produzir hexaciclodienos, que podem ser usados em outras transformações, como os cicloaditos de Diels Alder .
A química quântica também pode fornecer informações sobre o mecanismo de uma transformação orgânica sem a coleta de quaisquer dados experimentais. Como as funções de onda fornecem a energia total de um determinado estado molecular, as geometrias moleculares adivinhadas podem ser otimizadas para fornecer estruturas moleculares relaxadas muito semelhantes às encontradas por meio de métodos experimentais. As coordenadas de reação podem então ser simuladas e as estruturas de estado de transição resolvidas. Resolver uma superfície de energia completa para uma dada reação é, portanto, possível, e tais cálculos foram aplicados a muitos problemas em química orgânica onde os dados cinéticos não estão disponíveis ou são difíceis de adquirir.
Espectroscopia, espectrometria e cristalografia
A química física orgânica freqüentemente envolve a identificação da estrutura molecular, dinâmica e concentração de reagentes no curso de uma reação. A interação das moléculas com a luz pode fornecer uma riqueza de dados sobre tais propriedades por meio de experimentos espectroscópicos não destrutivos , com a luz absorvida quando a energia de um fóton corresponde à diferença de energia entre dois estados em uma molécula e emitida quando um estado excitado em uma molécula entra em colapso para um estado de energia mais baixo. As técnicas espectroscópicas são amplamente classificadas pelo tipo de excitação que está sendo sondada, como vibracional , rotacional , eletrônica , ressonância magnética nuclear (NMR) e espectroscopia de ressonância paramagnética de elétrons . Além dos dados espectroscópicos, a determinação da estrutura é frequentemente auxiliada por dados complementares coletados de difração de raios-X e experimentos de espectrometria de massa .
Espectroscopia NMR e EPR
Uma das ferramentas mais poderosas da química orgânica física é a espectroscopia de NMR . Um campo magnético externo aplicado a um núcleo paramagnético gera dois estados discretos, com valores de spin positivo e negativo divergindo em energia ; a diferença de energia pode então ser verificada determinando a frequência da luz necessária para excitar uma mudança no estado de spin para um determinado campo magnético. Os núcleos que não são indistinguíveis em uma determinada molécula absorvem em frequências diferentes, e a área de pico integrada em um espectro de NMR é proporcional ao número de núcleos que respondem a essa frequência. É possível quantificar a concentração relativa de diferentes moléculas orgânicas simplesmente por picos de integração no espectro, e muitos experimentos cinéticos podem ser fácil e rapidamente realizados seguindo o progresso de uma reação dentro de uma amostra de NMR. A RMN de prótons é frequentemente usada pelo químico orgânico sintético porque prótons associados a certos grupos funcionais fornecem energias de absorção características, mas a espectroscopia de RMN também pode ser realizada em isótopos de nitrogênio , carbono , flúor , fósforo , boro e uma série de outros elementos . Além de experimentos de absorção simples, também é possível determinar a taxa de reações de troca rápida de átomos por meio de medições de troca de supressão, distâncias interatômicas por meio de experimentos de efeito overhauser nuclear multidimensional e acoplamento spin-spin por ligação por espectroscopia de correlação homonuclear . Além das propriedades de excitação de spin dos núcleos, também é possível estudar as propriedades dos radicais orgânicos por meio da mesma técnica fundamental. Os elétrons desemparelhados também têm um spin líquido e um campo magnético externo permite a extração de informações semelhantes por meio da espectroscopia de ressonância paramagnética eletrônica (EPR).
Espectroscopia vibracional
A espectroscopia vibracional , ou espectroscopia infravermelha (IR), permite a identificação de grupos funcionais e, devido ao seu baixo custo e robustez, é frequentemente usada em laboratórios de ensino e no monitoramento em tempo real do progresso da reação em ambientes de difícil acesso (alta pressão , alta temperatura, fase gasosa, limites de fase ). As vibrações moleculares são quantizadas de maneira análoga às funções de onda eletrônicas, com aumentos inteiros na frequência levando a estados de energia mais elevados . A diferença de energia entre os estados vibracionais é quase constante, frequentemente caindo na faixa de energia correspondente aos fótons infravermelhos, porque em temperaturas normais as vibrações moleculares se assemelham a osciladores harmônicos . Ele permite a identificação crua de grupos funcionais em moléculas orgânicas , mas os espectros são complicados pelo acoplamento vibracional entre grupos funcionais próximos em moléculas complexas. Portanto, sua utilidade na determinação de estruturas é geralmente limitada a moléculas simples. Para complicar ainda mais, algumas vibrações não induzem uma mudança no momento de dipolo molecular e não serão observáveis com a espectroscopia de absorção de infravermelho padrão. Em vez disso, eles podem ser sondados por meio da espectroscopia Raman , mas essa técnica requer um aparato mais elaborado e é menos comumente realizada. No entanto, como a espectroscopia Raman depende da dispersão de luz, ela pode ser realizada em amostras microscópicas, como a superfície de um catalisador heterogêneo , um limite de fase ou em uma subamostra de um microlitro (µL) dentro de um volume de líquido maior. As aplicações da espectroscopia vibracional são freqüentemente usadas por astrônomos para estudar a composição de nuvens de gás molecular , atmosferas planetárias extrasolares e superfícies planetárias .

Espectroscopia de excitação eletrônica
A espectroscopia de excitação eletrônica , ou espectroscopia ultravioleta-visível (UV-vis), é realizada nas regiões visível e ultravioleta do espectro eletromagnético e é útil para sondar a diferença de energia entre a maior energia ocupada (HOMO) e a menor energia desocupada (LUMO ) orbitais moleculares . Essa informação é útil para os químicos orgânicos físicos no projeto de sistemas fotoquímicos orgânicos e corantes , pois a absorção de diferentes comprimentos de onda da luz visível dá cor às moléculas orgânicas . Uma compreensão detalhada de uma estrutura eletrônica é, portanto, útil para explicar as excitações eletrônicas e, por meio do controle cuidadoso da estrutura molecular, é possível ajustar a lacuna HOMO-LUMO para fornecer as cores desejadas e as propriedades do estado excitado.
Espectrometria de massa
A espectrometria de massa é uma técnica que permite a medição da massa molecular e oferece dados complementares às técnicas espectroscópicas de identificação estrutural. Em um experimento típico, uma amostra de fase gasosa de um material orgânico é ionizada e as espécies iônicas resultantes são aceleradas por um campo elétrico aplicado em um campo magnético . A deflexão transmitida pelo campo magnético, muitas vezes combinada com o tempo que leva para a molécula chegar a um detector, é então usada para calcular a massa da molécula. Freqüentemente, no decorrer da ionização da amostra, grandes moléculas se separam e os dados resultantes mostram uma massa parental e várias massas de fragmentos menores; tal fragmentação pode fornecer informações detalhadas sobre a sequência de proteínas e polímeros de ácido nucleico. Além da massa de uma molécula e seus fragmentos, a distribuição de massas variantes isotópicas também pode ser determinada e a presença qualitativa de certos elementos identificados devido à sua distribuição isotópica natural característica . A proporção da população de massa do fragmento para a população de íons parentais pode ser comparada com uma biblioteca de dados de fragmentação empírica e combinada com uma estrutura molecular conhecida. A combinação de cromatografia gasosa e espectrometria de massa é usada para identificar moléculas qualitativamente e medir quantitativamente a concentração com grande precisão e exatidão, e é amplamente usada para testar pequenas quantidades de biomoléculas e narcóticos ilícitos em amostras de sangue. Para químicos orgânicos sintéticos, é uma ferramenta útil para a caracterização de novos compostos e produtos de reação.
Cristalografia
Ao contrário dos métodos espectroscópicos, a cristalografia de raios-X sempre permite a determinação inequívoca da estrutura e fornece ângulos e comprimentos de ligação precisos totalmente indisponíveis por meio da espectroscopia. É frequentemente usado em físico-química orgânica para fornecer uma configuração molecular absoluta e é uma ferramenta importante para melhorar a síntese de uma substância enantiomérica pura . É também a única maneira de identificar a posição e a ligação de elementos que carecem de um núcleo ativo de RMN , como o oxigênio . De fato, antes que os métodos de determinação estrutural por raios X fossem disponibilizados no início do século 20, todas as estruturas orgânicas eram inteiramente conjeturais: o carbono tetraédrico , por exemplo, só foi confirmado pela estrutura cristalina do diamante , e a estrutura deslocalizada do benzeno foi confirmada pelo estrutura cristalina de hexametilbenzeno . Embora a cristalografia forneça aos químicos orgânicos dados altamente satisfatórios, não é uma técnica cotidiana em química orgânica porque um único cristal perfeito de um composto alvo deve ser cultivado. Apenas moléculas complexas, para as quais os dados de NMR não podem ser interpretados de forma inequívoca, requerem esta técnica. No exemplo abaixo, a estrutura do complexo hospedeiro-convidado teria sido bastante difícil de resolver sem uma única estrutura de cristal: não há prótons no fulereno e sem ligações covalentes entre as duas metades da espectroscopia do complexo orgânico sozinha. incapaz de provar a estrutura hipotética.

Leitura adicional
Em geral
- Peter Atkins & Julio de Paula, 2006, "Physicalochemical", 8th Edn., New York, NY, USA: Macmillan, ISBN 0716787598 , ver [2] , acessado em 21 de junho de 2015. [Por exemplo, ver p. 422 para uma descrição teórica / simétrica de grupo de orbitais atômicos que contribuem para a ligação no metano, CH 4 e pp. 390f para a estimativa da energia de ligação do elétron π para 1,3-butadieno pelo método de Hückel.]
- Thomas H. Lowry & Kathleen Schueller Richardson, 1987, Mechanism and Theory in Organic Chemistry, 3rd Edn., New York, NY, USA: Harper & Row, ISBN 0060440848 , ver [3] , acessado em 20 de junho de 2015. [The authoritative textbook sobre o assunto, contendo uma série de apêndices que fornecem detalhes técnicos sobre a teoria orbital molecular, efeitos de isótopos cinéticos, teoria do estado de transição e química radical.]
- Eric V. Anslyn & Dennis A. Dougherty, 2006, Modern Physical Organic Chemistry , Sausalito, Califórnia: University Science Books, ISBN 1891389319 . [Um tratamento modernizado e simplificado com ênfase em aplicativos e conexões interdisciplinares.]
- Michael B. Smith & Jerry March, 2007, "March's Advanced Organic Chemistry: Reactions, Mechanisms and Structure," 6th Ed., New York, NY, USA: Wiley & Sons, ISBN 0470084944 , ver [4] , acessado em 19 de junho 2015
- Francis A. Carey & Richard J. Sundberg, 2006, "Advanced Organic Chemistry: Part A: Structure and Mechanisms," 4th Edn., New York, NY, USA: Springer Science & Business Media, ISBN 0306468565 , ver [5] , acessado em 19 de junho de 2015.
História
- Hammond, George S. (1997). "Química físico-orgânica depois de 50 anos: mudou, mas ainda está aí?" (PDF) . Pure Appl. Chem. 69 (9): 1919–22. doi : 10.1351 / pac199769091919 . S2CID 53723796 . Retirado em 20 de junho de 2015 . [Um excelente ponto de partida na história do campo, de um contribuidor criticamente importante, referenciando e discutindo o texto antigo de Hammett, etc.]
Termoquímica
- LK Doraiswamy , 2005, "Estimation of properties of organic compostos (Ch. 3)," pp. 36-51, 118-124 (refs.), Em Organic Synthesis Engineering, Oxford, Oxon, ENG: Oxford University Press, ISBN 0198025696 , ver [6] , acessado em 22 de junho de 2015. (Este capítulo do livro examina uma ampla gama de propriedades físicas e suas estimativas, incluindo a lista restrita de propriedades termoquímicas que aparecem no artigo de WP de junho de 2015, colocando o método de Benson et al. muitos outros métodos. LK Doraiswamy é Anson Marston Distinguished Professor of Engineering na Iowa State University .)
- Irikura, Karl K .; Frurip, David J. (1998). "Computational Thermochemistry". Em Irikura, Karl K .; Frurip, David J. (eds.). Termoquímica Computacional: Predição e Estimação da Termodinâmica Molecular . Série de Simpósio ACS. 677 . American Chemical Society. pp. 2–18. doi : 10.1021 / bk-1998-0677.ch001 . ISBN 978-0-8412-3533-5 .
Veja também
- Journal of Physical Organic Chemistry
- Gaussiano, um exemplo de um pacote de software de mecânica quântica disponível comercialmente usado. particularmente, em ambientes acadêmicos



