Platinum - Platinum
 | |||||||||||||||||||||||||||||||||||||||||
| Platina | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Pronúncia |
/ P l ul t ɪ n əm / ( PLAT -in-əm ) |
||||||||||||||||||||||||||||||||||||||||
| Aparência | branco prateado | ||||||||||||||||||||||||||||||||||||||||
| Peso atômico padrão A r, std (Pt) | 195,084 (9) | ||||||||||||||||||||||||||||||||||||||||
| Platina na tabela periódica | |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| Número atômico ( Z ) | 78 | ||||||||||||||||||||||||||||||||||||||||
| Grupo | grupo 10 | ||||||||||||||||||||||||||||||||||||||||
| Período | período 6 | ||||||||||||||||||||||||||||||||||||||||
| Bloquear | bloco d | ||||||||||||||||||||||||||||||||||||||||
| Configuração de elétron | [ Xe ] 4f 14 5d 9 6s 1 | ||||||||||||||||||||||||||||||||||||||||
| Elétrons por camada | 2, 8, 18, 32, 17, 1 | ||||||||||||||||||||||||||||||||||||||||
| Propriedades físicas | |||||||||||||||||||||||||||||||||||||||||
| Fase em STP | sólido | ||||||||||||||||||||||||||||||||||||||||
| Ponto de fusão | 2041,4 K (1768,3 ° C, 3214,9 ° F) | ||||||||||||||||||||||||||||||||||||||||
| Ponto de ebulição | 4098 K (3825 ° C, 6917 ° F) | ||||||||||||||||||||||||||||||||||||||||
| Densidade (próximo à rt ) | 21,45 g / cm 3 | ||||||||||||||||||||||||||||||||||||||||
| quando líquido (em mp ) | 19,77 g / cm 3 | ||||||||||||||||||||||||||||||||||||||||
| Calor de fusão | 22,17 kJ / mol | ||||||||||||||||||||||||||||||||||||||||
| Calor da vaporização | 510 kJ / mol | ||||||||||||||||||||||||||||||||||||||||
| Capacidade de calor molar | 25,86 J / (mol · K) | ||||||||||||||||||||||||||||||||||||||||
Pressão de vapor
| |||||||||||||||||||||||||||||||||||||||||
| Propriedades atômicas | |||||||||||||||||||||||||||||||||||||||||
| Estados de oxidação | −3, −2, −1, 0, +1, +2 , +3, +4 , +5, +6 (um óxido ligeiramente básico ) | ||||||||||||||||||||||||||||||||||||||||
| Eletro-negatividade | Escala de Pauling: 2,28 | ||||||||||||||||||||||||||||||||||||||||
| Energias de ionização | |||||||||||||||||||||||||||||||||||||||||
| Raio atômico | empírico: 139 pm | ||||||||||||||||||||||||||||||||||||||||
| Raio covalente | 136 ± 17h | ||||||||||||||||||||||||||||||||||||||||
| Raio de Van der Waals | 175 pm | ||||||||||||||||||||||||||||||||||||||||
| Linhas espectrais de platina | |||||||||||||||||||||||||||||||||||||||||
| Outras propriedades | |||||||||||||||||||||||||||||||||||||||||
| Ocorrência natural | primordial | ||||||||||||||||||||||||||||||||||||||||
| Estrutura de cristal | cúbica de face centrada (FCC) | ||||||||||||||||||||||||||||||||||||||||
| Velocidade do som haste fina | 2800 m / s (à temperatura ambiente ) | ||||||||||||||||||||||||||||||||||||||||
| Expansão térmica | 8,8 µm / (m⋅K) (a 25 ° C) | ||||||||||||||||||||||||||||||||||||||||
| Condutividade térmica | 71,6 W / (m⋅K) | ||||||||||||||||||||||||||||||||||||||||
| Resistividade elétrica | 105 nΩ⋅m (a 20 ° C) | ||||||||||||||||||||||||||||||||||||||||
| Ordenação magnética | paramagnético | ||||||||||||||||||||||||||||||||||||||||
| Suscetibilidade magnética molar | +201,9 × 10 −6 cm 3 / mol (290 K) | ||||||||||||||||||||||||||||||||||||||||
| Resistência à tracção | 125–240 MPa | ||||||||||||||||||||||||||||||||||||||||
| Módulo de Young | 168 GPa | ||||||||||||||||||||||||||||||||||||||||
| Módulo de cisalhamento | 61 GPa | ||||||||||||||||||||||||||||||||||||||||
| Módulo de massa | 230 GPa | ||||||||||||||||||||||||||||||||||||||||
| Coeficiente de Poisson | 0,38 | ||||||||||||||||||||||||||||||||||||||||
| Dureza de Mohs | 3,5 | ||||||||||||||||||||||||||||||||||||||||
| Dureza Vickers | 400–550 MPa | ||||||||||||||||||||||||||||||||||||||||
| Dureza Brinell | 300–500 MPa | ||||||||||||||||||||||||||||||||||||||||
| Número CAS | 7440-06-4 | ||||||||||||||||||||||||||||||||||||||||
| História | |||||||||||||||||||||||||||||||||||||||||
| Descoberta | Antonio de Ulloa (1735) | ||||||||||||||||||||||||||||||||||||||||
| Principais isótopos de platina | |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
A platina é um elemento químico com o símbolo Pt e número atômico 78. É um metal de transição branco-prateado denso , maleável, dúctil , altamente não reativo, precioso . Seu nome é derivado do termo espanhol platino , que significa "pouca prata".
Platinum é membro do grupo de elementos platinum e do grupo 10 da tabela periódica de elementos . Possui seis isótopos naturais . É um dos elementos mais raros da crosta terrestre , com abundância média de aproximadamente 5 μg / kg. Ocorre em alguns minérios de níquel e cobre junto com alguns depósitos nativos , principalmente na África do Sul , que responde por 80% da produção mundial. Devido à sua escassez na crosta terrestre, apenas algumas centenas de toneladas são produzidas anualmente e, devido aos seus importantes usos, é altamente valioso e é um importante produto de metal precioso .
A platina é um dos metais menos reativos . Possui notável resistência à corrosão , mesmo em altas temperaturas, sendo, portanto, considerado um metal nobre . Consequentemente, a platina é frequentemente encontrada quimicamente não combinada como platina nativa. Por ocorrer naturalmente nas areias aluviais de vários rios, foi usado pela primeira vez por nativos pré-colombianos da América do Sul para produzir artefatos. Foi referenciado em escritos europeus já no século 16, mas foi só quando Antonio de Ulloa publicou um relatório sobre um novo metal de origem colombiana em 1748 que ele começou a ser investigado por cientistas.
A platina é usada em conversores catalíticos , equipamentos de laboratório, contatos elétricos e eletrodos , termômetros de resistência de platina , equipamentos odontológicos e joias. Por ser um metal pesado , causa problemas de saúde ao ser exposto aos seus sais ; mas, devido à sua resistência à corrosão, a platina metálica não foi associada a efeitos adversos à saúde. Os compostos que contêm platina, como cisplatina , oxaliplatina e carboplatina , são aplicados na quimioterapia contra certos tipos de câncer.
No início de 2021, o valor da platina variou de US $ 1.055 por onça troy a US $ 1.320 por onça troy.
Características
Fisica
A platina pura é um metal branco prateado brilhante, dúctil e maleável . A platina é mais dúctil do que o ouro , a prata ou o cobre , sendo, portanto, o mais dúctil dos metais puros, mas é menos maleável do que o ouro. O metal tem excelente resistência à corrosão , é estável em altas temperaturas e possui propriedades elétricas estáveis. Platina oxida, formando PtO
2, a 500 ° C; este óxido pode ser facilmente removido termicamente. Reage vigorosamente com flúor a 500 ° C (932 ° F) para formar tetrafluoreto de platina . Também é atacado por cloro , bromo , iodo e enxofre . A platina é insolúvel em ácido clorídrico e nítrico , mas se dissolve em água régia quente (uma mistura de ácidos nítrico e clorídrico), para formar ácido cloroplatínico , H
2PtCl
6.
Suas características físicas e estabilidade química o tornam útil para aplicações industriais. Sua resistência ao desgaste e ao embaçamento é adequada para uso em joalheria fina .
Químico
Os estados de oxidação mais comuns da platina são +2 e +4. Os estados de oxidação +1 e +3 são menos comuns e costumam ser estabilizados por ligações metálicas em espécies bimetálicas (ou polimetálicas). Como é esperado, os compostos tetracoordenados de platina (II) tendem a adotar geometrias planas quadradas de 16 elétrons . Embora a platina elementar geralmente não seja reativa, ela se dissolve na água régia quente para dar ácido cloroplatínico aquoso (H
2PtCl
6):
- Pt + 4 HNO
3 + 6 HCl → H
2PtCl
6 + 4 NÃO
2 + 4 H
2O
Como ácido mole , a platina tem grande afinidade com o enxofre, como o dimetilsulfóxido (DMSO); numerosos complexos DMSO foram relatados e deve-se tomar cuidado na escolha do solvente da reação.
Em 2007, o cientista alemão Gerhard Ertl ganhou o Prêmio Nobel de Química por determinar os mecanismos moleculares detalhados da oxidação catalítica do monóxido de carbono sobre a platina ( conversor catalítico ).
Isótopos
A platina tem seis isótopos de ocorrência natural : 190 Pt, 192 Pt, 194 Pt, 195 Pt, 196 Pt e 198 Pt. O mais abundante deles é 195 Pt, compreendendo 33,83% de toda a platina. É o único isótopo estável com spin diferente de zero. A rotação de 1 / 2 e outras propriedades magnéticas favoráveis do núcleo são utilizados em 195 Pt RMN . Devido ao seu spin e grande abundância, os picos do satélite 195 Pt também são frequentemente observados em espectroscopia de RMN 1 H e 31 P ( por exemplo, para complexos de Pt-fosfina e Pt-alquil). 190 Pt é o menos abundante com apenas 0,01%. Dos isótopos de ocorrência natural, apenas 190 Pt é instável, embora decaia com meia-vida de 6,5 × 10 11 anos, causando uma atividade de 15 Bq / kg de platina natural. 198 Pt pode sofrer decadência alfa , mas sua decadência nunca foi observada ( sabe-se que a meia-vida é superior a 3,2 × 10 14 anos); portanto, é considerado estável. A platina também tem 34 isótopos sintéticos que variam em massa atômica de 165 a 204, perfazendo o número total de isótopos conhecidos de 40. Os menos estáveis deles são 165 Pt e 166 Pt, com meia-vida de 260 µs, enquanto o mais estável é 193 Pt com meia-vida de 50 anos. A maioria dos isótopos de platina decai por alguma combinação de decaimento beta e decaimento alfa. 188 Pt, 191 Pt e 193 Pt decaem principalmente por captura de elétrons . Prevê-se que 190 Pt e 198 Pt tenham caminhos de decaimento beta duplo energeticamente favoráveis .
Ocorrência
A platina é um metal extremamente raro, ocorrendo em uma concentração de apenas 0,005 ppm na crosta terrestre . Às vezes é confundido com prata. A platina é frequentemente encontrada quimicamente não combinada como platina nativa e como liga com os outros metais do grupo da platina e principalmente ferro . Na maioria das vezes, a platina nativa é encontrada em depósitos secundários em depósitos aluviais . Os depósitos aluviais usados por povos pré-colombianos no departamento de Chocó , na Colômbia , ainda são uma fonte de metais do grupo da platina. Outro grande depósito aluvial está nos Montes Urais , na Rússia, e ainda é minerado.
Em níquel e cobre depósitos, metais do grupo da platina ocorrer como sulfuretos (por exemplo, (Pt, Pd) S) , teluretos (por exemplo, PtBiTe ), antimonides (PdSb), e arsenietos (por exemplo PTAS
2), e como ligas finais com níquel ou cobre. Arsenieto de platina, esperrilita ( PtAs
2), é uma importante fonte de platina associada aos minérios de níquel no depósito da Bacia de Sudbury em Ontário , Canadá . Em Platinum, Alasca , cerca de 17.000 kg (550.000 ozt) foram extraídos entre 1927 e 1975. A mina encerrou as operações em 1990. O mineral sulfureto raro cooperite , (Pt, Pd, Ni) S , contém platina junto com paládio e níquel. Cooperite ocorre no recife Merensky dentro do complexo Bushveld , Gauteng , África do Sul .
Em 1865, as cromitas foram identificadas na região de Bushveld da África do Sul, seguido pela descoberta de platina em 1906. Em 1924, o geólogo Hans Merensky descobriu um grande suprimento de platina no Complexo Ígnea de Bushveld na África do Sul. A camada específica que ele encontrou, chamada de Recife Merensky , contém cerca de 75% da platina mundialmente conhecida. Os grandes depósitos de cobre e níquel próximos a Norilsk, na Rússia , e na Bacia de Sudbury , no Canadá , são os outros dois grandes depósitos. Na Bacia de Sudbury, as enormes quantidades de minério de níquel processadas compensam o fato de a platina estar presente como apenas 0,5 ppm no minério. Reservas menores podem ser encontradas nos Estados Unidos, por exemplo, na cordilheira Absaroka, em Montana . Em 2010, a África do Sul foi o maior produtor de platina, com quase 77% de participação, seguida pela Rússia com 13%; a produção mundial em 2010 foi de 192.000 kg (423.000 lb).
Grandes depósitos de platina estão presentes no estado de Tamil Nadu , na Índia .
A platina existe em maior abundância na Lua e em meteoritos. Correspondentemente, a platina é encontrada em abundâncias ligeiramente maiores em locais de impacto de bólido na Terra que estão associados ao vulcanismo pós-impacto resultante e pode ser minerada economicamente; a Bacia de Sudbury é um exemplo.
Compostos
Halides
O ácido hexacloroplatínico mencionado acima é provavelmente o composto de platina mais importante, pois serve como o precursor de muitos outros compostos de platina. Por si só, tem várias aplicações em fotografia, gravuras de zinco, tinta indelével , galvanização, espelhos, coloração de porcelana e como catalisador.
O tratamento do ácido hexacloroplatínico com um sal de amônio, como cloreto de amônio , dá hexacloroplatinato de amônio , que é relativamente insolúvel em soluções de amônio. O aquecimento desse sal de amônio na presença de hidrogênio o reduz a platina elementar. O hexacloroplatinato de potássio é igualmente insolúvel e o ácido hexacloroplatínico tem sido usado na determinação de íons de potássio por gravimetria .
Quando o ácido hexacloroplatínico é aquecido, ele se decompõe através do cloreto de platina (IV) e cloreto de platina (II) em platina elementar, embora as reações não ocorram gradativamente:
- (H
3O)
2PtCl
6· N H
2O ⇌ PtCl
4+ 2 HCl + ( n + 2) H
2O - PtCl
4 ⇌ PtCl
2 + Cl
2 - PtCl
2 ⇌ Pt + Cl
2
Todas as três reações são reversíveis. Os brometos de platina (II) e de platina (IV) também são conhecidos. O hexafluoreto de platina é um oxidante forte capaz de oxidar o oxigênio .
Óxidos
Óxido de platina (IV) , PtO
2, também conhecido como ' catalisador de Adams' , é um pó preto solúvel em soluções de hidróxido de potássio (KOH) e ácidos concentrados. PtO
2e o menos comum PtO se decompõe com o aquecimento. Óxido de platina (II, IV), Pt
3O
4, é formado na seguinte reação:
- 2 Pt 2+ + Pt 4+ + 4 O 2− → Pt
3O
4
Outros compostos
Ao contrário do acetato de paládio , o acetato de platina (II) não está disponível comercialmente. Onde uma base é desejada, os halogenetos têm sido usados em conjunto com acetato de sódio . O uso de acetilacetonato de platina (II) também foi relatado.
Vários platinídeos de bário foram sintetizados nos quais a platina exibe estados de oxidação negativos variando de -1 a -2. Isso inclui BaPt, Ba
3Pt
2e Ba
2Pt . Platinida de césio, Cs
2Pt , um composto cristalino transparente vermelho escuro, demonstrou conter Pt2−
ânions. A platina também exibe estados de oxidação negativos em superfícies reduzidas eletroquimicamente. Os estados de oxidação negativos exibidos pela platina são incomuns para elementos metálicos e são atribuídos à estabilização relativística dos orbitais 6s.
Prevê-se que mesmo o cátion PtO 4 2+ no qual a platina existe no estado de oxidação +10 pode ser alcançado.
O sal de Zeise , contendo um ligante de etileno , foi um dos primeiros compostos organometálicos descobertos. Dicloro (cicloocta-1,5-dieno) platina (II) é um complexo de olefina disponível comercialmente , que contém ligantes de bacalhau facilmente deslocáveis ("bacalhau" é uma abreviatura de 1,5-ciclooctadieno). O complexo de bacalhau e os halogenetos são pontos de partida convenientes para a química da platina.
A cisplatina , ou cis- diaminodicloroplatina (II), é a primeira de uma série de drogas quimioterápicas contendo platina (II) quadrada planar. Outros incluem carboplatina e oxaliplatina . Esses compostos são capazes de reticular DNA e matar células por vias semelhantes aos agentes quimioterápicos alquilantes . (Os efeitos colaterais da cisplatina incluem náuseas e vômitos, perda de cabelo, zumbido, perda auditiva e nefrotoxicidade.)
Compostos de organoplatina , tais como os agentes antitumorais acima, bem como complexos de platina inorgânicos solúveis, são rotineiramente caracterizados usando espectroscopia de ressonância magnética nuclear 195 Pt .
História
Primeiros usos
Os arqueólogos descobriram vestígios de platina no ouro usado em antigos túmulos egípcios já em 1200 aC. Por exemplo, uma pequena caixa do enterro de Shepenupet II foi encontrada decorada com hieróglifos de ouro-platina. No entanto, a extensão do conhecimento dos primeiros egípcios sobre o metal não é clara. É bem possível que eles não tenham reconhecido que havia platina em seu ouro.
O metal foi usado por americanos pré-colombianos perto de Esmeraldas, Equador, para produzir artefatos de uma liga de ouro branco e platina. Os arqueólogos geralmente associam a tradição de trabalhar a platina na América do Sul com a cultura La Tolita (cerca de 600 aC - 200 dC), mas datas e localização precisas são difíceis, já que a maioria dos artefatos de platina da área foram comprados de segunda mão através do comércio de antiguidades, em vez de obtido por escavação arqueológica direta. Para trabalhar o metal, eles combinariam pó de ouro e platina por sinterização . A liga de ouro-platina resultante seria então macia o suficiente para ser modelada com ferramentas. A platina usada em tais objetos não era o elemento puro, mas sim uma mistura natural dos metais do grupo da platina , com pequenas quantidades de paládio, ródio e irídio.
Descoberta europeia
A primeira referência europeia à platina aparece em 1557 nos escritos do humanista italiano Júlio César Scaliger como uma descrição de um metal nobre desconhecido encontrado entre Darién e o México, "que nenhum fogo nem nenhum artifício espanhol foi ainda capaz de liquefazer". Desde seus primeiros encontros com a platina, os espanhóis geralmente viam o metal como uma espécie de impureza no ouro, e era tratado como tal. Muitas vezes era simplesmente jogado fora e havia um decreto oficial proibindo a adulteração de ouro com impurezas de platina.

Em 1735, Antonio de Ulloa e Jorge Juan y Santacilia viram os nativos americanos minerando platina enquanto os espanhóis viajavam pela Colômbia e Peru por oito anos. Ulloa e Juan encontraram minas com pepitas de metal esbranquiçadas e as levaram para a Espanha. Antonio de Ulloa voltou à Espanha e estabeleceu o primeiro laboratório de mineralogia na Espanha e foi o primeiro a estudar sistematicamente a platina, que foi em 1748. Seu relato histórico da expedição incluía uma descrição da platina como sendo nem separável nem calcinável . Ulloa também antecipou a descoberta de minas de platina. Depois de publicar o relatório em 1748, Ulloa não continuou a investigar o novo metal. Em 1758, ele foi enviado para supervisionar as operações de mineração de mercúrio em Huancavelica .
Em 1741, Charles Wood, um metalúrgico britânico , encontrou várias amostras de platina colombiana na Jamaica, que enviou a William Brownrigg para uma investigação mais aprofundada.
Em 1750, depois de estudar a platina enviada a ele por Wood, Brownrigg apresentou um relato detalhado do metal à Royal Society , afirmando que não havia visto nenhuma menção a ele em nenhum relato anterior de minerais conhecidos. Brownrigg também observou o ponto de fusão extremamente alto da platina e a refratariedade ao bórax . Outros químicos em toda a Europa logo começaram a estudar platina, incluindo Andreas Sigismund Marggraf , Torbern Bergman , Jöns Jakob Berzelius , William Lewis e Pierre Macquer . Em 1752, Henrik Scheffer publicou uma descrição científica detalhada do metal, que ele chamou de "ouro branco", incluindo um relato de como ele conseguiu fundir minério de platina com a ajuda de arsênico . Scheffer descreveu a platina como sendo menos flexível do que o ouro, mas com resistência semelhante à corrosão.
Meios de maleabilidade
Carl von Sickingen pesquisou extensivamente a platina em 1772. Ele conseguiu fazer platina maleável ligando -a ao ouro, dissolvendo a liga em água régia quente , precipitando a platina com cloreto de amônio , acendendo o cloroplatinato de amônio e martelando a platina finamente dividida resultante para fazer é coerente. Franz Karl Achard fez o primeiro cadinho de platina em 1784. Ele trabalhou com a platina fundindo-a com arsênico e, em seguida, volatilizando o arsênico.
Como os outros membros da família da platina ainda não foram descobertos (a platina era a primeira da lista), Scheffer e Sickingen fizeram a falsa suposição de que, devido à sua dureza - que é um pouco mais do que o ferro puro - a platina seria relativamente não material flexível, às vezes até quebradiço, quando na verdade sua ductilidade e maleabilidade são próximas às do ouro. Suas suposições não puderam ser evitadas porque a platina com a qual eles experimentaram estava altamente contaminada com pequenas quantidades de elementos da família da platina, como ósmio e irídio , entre outros, que fragilizaram a liga de platina. Unir esse resíduo impuro de platina chamado "plioxeno" com ouro era a única solução na época para se obter um composto maleável, mas hoje em dia existe platina muito pura e fios extremamente longos podem ser extraídos da platina pura, com muita facilidade, devido ao seu cristalino estrutura, que é semelhante à de muitos metais macios.
Em 1786, Carlos III da Espanha forneceu uma biblioteca e um laboratório a Pierre-François Chabaneau para auxiliá-lo em suas pesquisas sobre a platina. Chabaneau conseguiu remover várias impurezas do minério, incluindo ouro, mercúrio, chumbo, cobre e ferro. Isso o levou a acreditar que estava trabalhando com um único metal, mas na verdade o minério ainda continha os metais do grupo da platina ainda não descobertos. Isso levou a resultados inconsistentes em seus experimentos. Às vezes, a platina parecia maleável, mas quando era ligada ao irídio, seria muito mais frágil . Às vezes, o metal era totalmente incombustível, mas quando ligado ao ósmio, ele volatilizava. Depois de vários meses, Chabaneau conseguiu produzir 23 quilos de platina pura e maleável martelando e comprimindo a forma de esponja enquanto incandescente. Chabeneau percebeu que a infusibilidade da platina iria agregar valor aos objetos feitos dela, e então abriu um negócio com Joaquín Cabezas, produzindo lingotes e utensílios de platina. Isso deu início ao que é conhecido como a "era da platina" na Espanha.
Produção
A platina, junto com o resto dos metais do grupo da platina , é obtida comercialmente como um subproduto da mineração e processamento de níquel e cobre . Durante a eletrorrefinação do cobre , metais nobres como prata, ouro e metais do grupo da platina, bem como selênio e telúrio, depositam-se no fundo da célula como "lama anódica", que constitui o ponto de partida para a extração do grupo da platina metais.
Se a platina pura for encontrada em depósitos de placer ou outros minérios, ela é isolada deles por vários métodos de subtração de impurezas. Como a platina é significativamente mais densa do que muitas de suas impurezas, as impurezas mais leves podem ser removidas simplesmente flutuando-as em um líquido. A platina é paramagnética , enquanto o níquel e o ferro são ferromagnéticos . Essas duas impurezas são então removidas passando-se um eletroímã sobre a mistura. Como a platina tem um ponto de fusão mais alto do que a maioria das outras substâncias, muitas impurezas podem ser queimadas ou derretidas sem derreter a platina. Finalmente, a platina é resistente aos ácidos clorídrico e sulfúrico, enquanto outras substâncias são prontamente atacadas por eles. As impurezas metálicas podem ser removidas agitando a mistura em qualquer um dos dois ácidos e recuperando a platina restante.
Um método adequado para purificação da platina bruta, que contém platina, ouro e outros metais do grupo da platina, é processá-la com água régia , na qual paládio, ouro e platina são dissolvidos, enquanto ósmio, irídio, rutênio e ródio permaneça sem reagir. O ouro é precipitado pela adição de cloreto de ferro (II) e, após a filtração do ouro, a platina é precipitada como cloroplatinato de amônio pela adição de cloreto de amônio . O cloroplatinato de amônio pode ser convertido em platina por aquecimento. O hexacloroplatinato (IV) não precipitado pode ser reduzido com zinco elementar , e um método semelhante é adequado para a recuperação em pequena escala de platina de resíduos de laboratório. A mineração e o refino de platina têm impactos ambientais.
Formulários

Das 218 toneladas de platina vendidas em 2014, 98 toneladas foram usadas para dispositivos de controle de emissões de veículos (45%), 74,7 toneladas para joias (34%), 20,0 toneladas para produção de produtos químicos e refino de petróleo (9,2%) e 5,85 toneladas para aplicações elétricas, como unidades de disco rígido (2,7%). As 28,9 toneladas restantes foram para várias outras aplicações menores, como medicina e biomedicina, equipamentos de fabricação de vidro, investimentos, eletrodos, medicamentos anticâncer, sensores de oxigênio , velas de ignição e motores de turbina.
Catalisador
O uso mais comum da platina é como catalisador em reações químicas, geralmente como negro de platina . Tem sido empregado como catalisador desde o início do século 19, quando o pó de platina foi usado para catalisar a ignição do hidrogênio. Sua aplicação mais importante é em automóveis como conversor catalítico , que permite a combustão completa de baixas concentrações de hidrocarbonetos não queimados do escapamento em dióxido de carbono e vapor d'água. A platina também é usada na indústria do petróleo como um catalisador em vários processos separados, mas especialmente na reforma catalítica de naftas de destilação direta em gasolina de alta octanagem que se torna rica em compostos aromáticos. PtO
2, também conhecido como catalisador de Adams , é utilizado como catalisador de hidrogenação, especificamente para óleos vegetais . A platina também catalisa fortemente a decomposição do peróxido de hidrogênio em água e oxigênio e é usada em células a combustível como um catalisador para a redução do oxigênio .
Padrão

De 1889 a 1960, o medidor foi definido como o comprimento de uma barra de liga de platina-irídio (90:10), conhecido como medidor de protótipo internacional . A barra anterior era de platina em 1799. Até maio de 2019, o quilograma era definido como a massa do protótipo internacional do quilograma , um cilindro da mesma liga platina-irídio fabricado em 1879.
O Termômetro de Resistência de Platina Padrão (SPRT) é um dos quatro tipos de termômetros usados para definir a Escala Internacional de Temperatura de 1990 (ITS-90), o padrão de calibração internacional para medições de temperatura. O fio de resistência no termômetro é feito de platina pura (por exemplo, o NIST fabricou os fios de barra de platina com pureza química de 99,999% em peso). Além de usos laboratoriais, a termometria de resistência de platina (PRT) também tem muitas aplicações industriais. Os padrões industriais incluem ASTM E1137 e IEC 60751.
O eletrodo de hidrogênio padrão também usa um eletrodo de platina platinizado devido à sua resistência à corrosão e outros atributos.
Como um investimento
A platina é uma mercadoria de metal precioso ; seu ouro tem o código de moeda ISO XPT. Moedas, barras e lingotes são comercializados ou coletados. A platina é usada em joias, geralmente como uma liga de 90-95%, devido à sua inércia. É usado para esse fim por seu prestígio e valor de ouro inerente. Publicações de comércio de joalheria aconselham joalheiros a apresentarem arranhões superficiais minúsculos (que eles chamam de pátina ) como uma característica desejável na tentativa de aumentar o valor dos produtos de platina.
Na relojoaria , a Vacheron Constantin , a Patek Philippe , a Rolex , a Breitling e outras empresas usam platina para produzir sua série de relógios de edição limitada. Os relojoeiros apreciam as propriedades únicas da platina, pois ela não mancha nem se desgasta (a última qualidade em relação ao ouro).
Durante períodos de estabilidade econômica sustentada e crescimento, o preço da platina tende a ser até duas vezes o preço do ouro, enquanto durante períodos de incerteza econômica, o preço da platina tende a diminuir devido à redução da demanda industrial, caindo abaixo do preço de ouro. Os preços do ouro são mais estáveis em tempos econômicos lentos, já que o ouro é considerado um porto seguro. Embora o ouro também seja usado em aplicações industriais, especialmente em eletrônica, devido ao seu uso como condutor, sua demanda não é tão impulsionada por usos industriais. No século 18, a raridade da platina fez com que o rei Luís XV da França a declarasse o único metal digno de um rei.
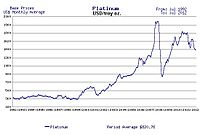
Preço médio da platina de 1992 a 2012 em US $ por onça troy
Outros usos
No laboratório, o fio de platina é usado para eletrodos; As bandejas e suportes de platina são usados em análises termogravimétricas por causa dos requisitos rigorosos de inércia química durante o aquecimento a altas temperaturas (~ 1000 ° C). A platina é usada como um agente de liga para vários produtos de metal, incluindo fios finos, recipientes de laboratório não corrosivos, instrumentos médicos, próteses dentárias, contatos elétricos e termopares. Platina-cobalto, uma liga de aproximadamente três partes de platina e uma parte de cobalto, é usada para fazer ímãs permanentes relativamente fortes . Os ânodos à base de platina são usados em navios, dutos e píeres de aço. Os medicamentos de platina são usados para tratar uma ampla variedade de cânceres, incluindo carcinomas testiculares e de ovário, melanoma, câncer de pulmão de células pequenas e não pequenas, mielomas e linfomas.
Símbolo de prestígio em marketing
A raridade da platina como metal fez com que os anunciantes a associassem com exclusividade e riqueza. Os cartões de débito e crédito "Platinum" têm maiores privilégios do que os cartões " gold ". Os " prêmios de platina " são os segundos mais altos possíveis, ficando acima de "ouro", " prata " e " bronze ", mas abaixo do diamante . Por exemplo, nos Estados Unidos, um álbum musical que vendeu mais de 1 milhão de cópias será creditado como "platina", enquanto um álbum que vendeu mais de 10 milhões de cópias será certificado como "diamante". Alguns produtos, como liquidificadores e veículos, de cor branco prateado são identificados como "platina". A platina é considerada um metal precioso, embora seu uso não seja tão comum quanto o uso de ouro ou prata. A moldura da Coroa da Rainha Elizabeth, a Rainha Mãe , fabricada para sua coroação como Consorte do Rei George VI , é feita de platina. Foi a primeira coroa britânica a ser feita desse metal em particular.
Problemas de saúde
De acordo com os Centros de Controle e Prevenção de Doenças , a exposição de curto prazo aos sais de platina pode causar irritação nos olhos, nariz e garganta, e a exposição de longo prazo pode causar alergias respiratórias e cutâneas. O padrão OSHA atual é de 2 microgramas por metro cúbico de ar em média em um turno de trabalho de 8 horas. O Instituto Nacional de Segurança e Saúde Ocupacional definiu um limite de exposição recomendado (REL) para a platina como 1 mg / m 3 em um dia de trabalho de 8 horas.
Como a platina é um catalisador na fabricação da borracha de silicone e componentes de gel de vários tipos de implantes médicos (implantes mamários, próteses de substituição de articulações, discos lombares artificiais, portas de acesso vascular, etc.), a possibilidade de a platina entrar no corpo e causar efeitos adversos merece estudo. A Food and Drug Administration e outras instituições analisaram a questão e não encontraram evidências que sugiram toxicidade in vivo . A platina quimicamente ilimitada foi identificada pelo FDA como uma "falsa 'cura' do câncer". O mal-entendido é criado por profissionais de saúde que estão usando inadequadamente o nome do metal como gíria para medicamentos quimioterápicos à base de platina, como a cisplatina. Eles são compostos de platina, não o metal em si.
Veja também
Referências
Leitura adicional
- Young, Gordon (novembro de 1983). "The Miracle Metal - Platinum". National Geographic . Vol. 164 no. 5. pp. 686–706. ISSN 0027-9358 . OCLC 643483454 .
links externos
- Platinum na The Periodic Table of Videos (University of Nottingham)
- Nuclides and Isotopes Décima Quarta Edição: Chart of the Nuclides , General Electric Company, 1989.
- Guia de bolso do NIOSH para perigos químicos - Centros de platina para controle e prevenção de doenças
- "O banco de dados PGM" .
- "Um relato histórico equilibrado da sequência de descobertas da platina; ilustrado" .
- "Johnson Matthey Technology Review: Um jornal trimestral gratuito de pesquisa que explora ciência e tecnologia em aplicações industriais (anteriormente publicado como Platinum Metals Review)" .
- "Estatísticas e informações sobre metais do grupo da platina" . Pesquisa Geológica dos Estados Unidos.
- "International Platinum Group Metals Association" .