Heptafluorotantalato de potássio - Potassium heptafluorotantalate
|
|
| Nomes | |
|---|---|
|
Nome IUPAC
Heptafluorotantalato dipotássico
|
|
|
Nome IUPAC sistemático
Dipotassium heptafluorotantalum (2-) |
|
| Outros nomes
Heptafluorotantalato de potássio (V)
Fluorotantalato de potássio |
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| ChemSpider | |
| ECHA InfoCard |
100.037.245 |
| Número EC | |
|
PubChem CID
|
|
|
Painel CompTox ( EPA )
|
|
|
|
|
|
| Propriedades | |
| K 2 [TaF 7 ] | |
| Massa molar | 392,13 g / mol |
| Aparência | sólido branco |
| Densidade | 4,56 g / mL a 25 ° C |
| Ponto de fusão | 630 a 820 ° C (1.166 a 1.508 ° F; 903 a 1.093 K) |
| 0,5 g / 100 mL (15 ° C) | |
| Perigos | |
| Pictogramas GHS |
 
|
| Palavra-sinal GHS | perigo |
| H301 , H315 , H319 , H331 , H335 | |
| P261 , P264 , P270 , P271 , P280 , P301 + 310 , P302 + 352 , P304 + 340 , P305 + 351 + 338 , P311 , P312 , P321 , P330 , P332 + 313 , P337 + 313 , P362 , P403 + 233 , P405 , P501 | |
| Dose ou concentração letal (LD, LC): | |
|
LD 50 ( dose mediana )
|
110 mg / kg (Oral: rato) |
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Referências da Infobox | |
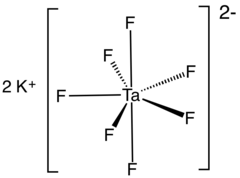
O heptafluorotantalato de potássio é um composto inorgânico com a fórmula K 2 [TaF 7 ]. É o sal de potássio do ânion heptafluorotantalato [TaF 7 ] 2− . Este sólido branco solúvel em água é um intermediário na purificação do tântalo de seus minérios e é o precursor do metal.
Preparação
Industrial
O heptafluorotantalato de potássio é um intermediário na produção industrial de tântalo metálico. Sua produção envolve a lixiviação de minérios de tântalo, como columbita e tantalita , com ácido fluorídrico e ácido sulfúrico para produzir o pentafluorotantalato de hidrogênio solúvel em água.
- Ta 2 O 5 + 14 HF → 2 H 2 [TaF 7 ] + 5 H 2 O
Esta solução é submetida a uma série de etapas de extração líquido-líquido para remover impurezas metálicas (mais importante nióbio ) antes de ser tratada com fluoreto de potássio para produzir K 2 [TaF 7 ]
Escala de laboratório
O ácido fluorídrico é corrosivo e tóxico, tornando-o desagradável de se trabalhar; como tal, vários processos alternativos foram desenvolvidos para sínteses em pequena escala. O heptafluorotantalato de potássio pode ser produzido por métodos anidro e úmido. O método anidro envolve a reação de óxido de tântalo com bifluoreto de potássio ou bifluoreto de amônio de acordo com a seguinte equação:
- Ta 2 O 5 + 4 KHF 2 + 6 HF → 2 K 2 [TaF 7 ] + 5 H 2 O
O método foi originalmente relatado por Berzelius .
K 2 [TaF 7 ] também pode ser precipitado de soluções em ácido fluorídrico, desde que a concentração de HF seja inferior a cerca de 42%. Soluções com concentrações mais altas de HF produzem hexafluorotantalato de potássio [KTaF 6 ]. O sal de K também pode ser precipitado de uma solução em ácido fluorídrico de pentacloreto de tântalo :
- 5 HF + 2 KF + TaCl 5 → K 2 [TaF 7 ] + 5 HCl
Estrutura
O heptafluorotantalato de potássio existe em pelo menos dois polimorfos . α-K 2 [TaF 7 ] é a forma mais comum e cristaliza no grupo espacial P 2 1 / c monoclínico . A estrutura é composta por [TaF 7 ] 2− unidades interconectadas por íons de potássio. Os poliedros [TaF 7 ] 2− podem ser descritos como prismas trigonais monocapa com o átomo de cobertura localizado em uma das faces retangulares. Os átomos de potássio são coordenados em 9 e podem ser vistos como prismas quadrados monocapa distorcidos .
Em temperaturas acima de 230 ° C, isso se converte em β-K 2 [TaF 7 ], que é ortorrômbico (grupo espacial: P nma). Esta estrutura também consiste em íons de potássio e o ânion complexo [TaF 7 ] 2− . A estrutura das unidades de 7 coordenadas [TaF 7 ] 2− é essencialmente inalterada. No entanto, os átomos de potássio agora existem em 2 ambientes onde eles se coordenam para 11 ou 8 átomos de flúor.
Reações
K 2 [TaF 7 ] é usado principalmente para produzir tântalo metálico por redução com sódio . Isso ocorre a aproximadamente 800 ° C no sal fundido e prossegue por meio de várias vias potenciais.
K 2 [TaF 7 ] é suscetível à hidrólise. Por exemplo, uma solução aquosa em ebulição de K 2 [TaF 7 ] produz oxifluorotantalato de potássio (K 2 Ta 2 O 3 F 6 ), conhecido como " sal de Marignac ". Para prevenir a hidrólise e a co-precipitação de oxifluorotantalato de potássio, um pequeno excesso de HF é adicionado à solução.
