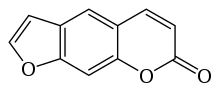
Psoralen - Psoralen
|
|
| Nomes | |
|---|---|
|
Nome IUPAC preferido
7 H -Furo [3,2- g ] [1] benzopiran-7-ona |
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| 152784 | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| ECHA InfoCard |
100.000.581 |
| Número EC | |
| KEGG | |
|
PubChem CID
|
|
| UNII | |
|
Painel CompTox ( EPA )
|
|
|
|
|
|
| Propriedades | |
| C 11 H 6 O 3 | |
| Massa molar | 186,16 g / mol |
| Ponto de fusão | 158 a 161 ° C (316 a 322 ° F; 431 a 434 K) |
| Perigos | |
| Pictogramas GHS |

|
| Palavra-sinal GHS | Aviso |
| H302 , H315 , H319 , H335 | |
| P261 , P264 , P270 , P271 , P280 , P301 + 312 , P302 + 352 , P304 + 340 , P305 + 351 + 338 , P312 , P321 , P330 , P332 + 313 , P337 + 313 , P362 , P403 + 233 , P405 , P501 | |
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Referências da Infobox | |
O psoraleno (também chamado de psoraleno ) é o composto original em uma família de compostos orgânicos naturais conhecidos como furanocumarinas lineares . É estruturalmente relacionado à cumarina pela adição de um anel de furano fundido e pode ser considerado um derivado da umbeliferona . O psoraleno ocorre naturalmente nas sementes de Psoralea corylifolia , bem como no figo comum , aipo , salsa , pau-cetim das Índias Ocidentais e em todas as frutas cítricas . É amplamente utilizado no tratamento com PUVA (psoraleno + UVA ) para psoríase , eczema , vitiligo e linfoma cutâneo de células T ; essas aplicações são normalmente feitas com o uso de medicamentos como Methoxsalen . Muitas furanocumarinas são extremamente tóxicas para os peixes e algumas são depositadas em riachos na Indonésia para a captura de peixes.
Usos
O psoraleno é um mutagênico utilizado para esse fim na pesquisa em biologia molecular. O psoraleno intercala-se em DNA e, por exposição à radiação ultravioleta (UVA), pode formar monoadutos e ligações cruzadas covalentes entre cadeias (ICL) com tinas, preferencialmente em sítios 5'-TpA no genoma, induzindo apoptose . A terapia com psoraleno mais UVA (PUVA) pode ser usada para tratar doenças hiperproliferativas da pele, como psoríase e certos tipos de câncer de pele . Infelizmente, o próprio tratamento com PUVA leva a um risco maior de câncer de pele.
Um uso importante do psoraleno é no tratamento com PUVA para problemas de pele como psoríase e, em menor grau, eczema e vitiligo . Isso aproveita a alta absorção de UV do psoraleno. O psoraleno é aplicado primeiro para sensibilizar a pele, depois a luz UVA é aplicada para limpar o problema de pele. O psoraleno também é recomendado para o tratamento da alopecia . Os psoralenos também são usados na fotoforese , onde são misturados aos leucócitos extraídos antes da aplicação da radiação ultravioleta.
Apesar das fotocancerígenos propriedades do psoraleno, que foi utilizado como um activador de curtimento em protectores solares até 1996. Os psoralenos são utilizados em aceleradores de curtimento, dado que os aumentos de psoraleno a sensibilidade da pele à luz. Alguns pacientes tiveram perda severa de pele após banhos de sol com ativadores de bronzeamento contendo psoraleno. Pacientes com pele mais clara sofrem quatro vezes mais com as propriedades geradoras de melanoma dos psoralenos do que aqueles com pele mais escura. Os efeitos colaterais de curto prazo dos psoralenos incluem náusea, vômito, eritrema, prurido, xerose, dor na pele devido a dano fototóxico do nervo dérmico e pode causar malignidades cutâneas e genitais na pele.
Um uso adicional para psoralênicos otimizados é para a inativação de patógenos em produtos sangüíneos. O amino-psoraleno sintético, amotosaleno HCl, foi desenvolvido para a inativação de patógenos infecciosos (bactérias, vírus, protozoários) em componentes do sangue de plaquetas e plasma preparados para suporte transfusional de pacientes. Antes do uso clínico, as plaquetas tratadas com amotosaleno foram testadas e consideradas não cancerígenas ao usar o modelo de camundongo nocaute p53 estabelecido . A tecnologia está atualmente em uso rotineiro em alguns hemocentros europeus e foi recentemente aprovada nos Estados Unidos.
Química
O psoraleno intercala na dupla hélice do DNA, onde está idealmente posicionado para formar um ou mais adutos com bases pirimidinas adjacentes, preferencialmente timina, após excitação por um fóton ultravioleta.
Vários métodos físico-químicos têm sido empregados para derivar constantes de ligação para interações psoraleno-DNA. Classicamente, duas câmaras de psoraleno e solução tamponada de DNA são divididas por uma membrana semipermeável ; a afinidade do psoraleno pelo DNA está diretamente relacionada à concentração do psoraleno na câmara de DNA após o equilíbrio. A solubilidade em água é importante por duas razões: farmacocinética relacionada à solubilidade do medicamento no sangue e necessidade do uso de solventes orgânicos (por exemplo, DMSO ). Os psoralenos também podem ser ativados por irradiação com luz ultravioleta de longo comprimento de onda. Embora a luz de alcance UVA seja o padrão clínico, a pesquisa de que o UVB é mais eficiente na formação de fotoadutos sugere que seu uso pode levar a uma maior eficácia e menores tempos de tratamento.
Os locais fotoquimicamente reativos em psoralenos são as ligações duplas carbono-carbono semelhantes a alceno no anel furano (o anel de cinco membros) e o anel pirona (o anel de seis membros). Quando apropriadamente intercalada adjacente a uma base de pirimidina, uma reação de fotociclobutilização de quatro centros pode levar à formação de qualquer um dos dois monoaddutos do tipo ciclobutila. Normalmente, os monoaddutos do lado do furano se formam em uma proporção maior. O monoaducto de furano pode absorver um segundo fóton UVA levando a uma segunda fotociclidição de quatro centros na extremidade da pirona da molécula e, portanto, a formação de um diaduto ou reticulação. Monoadutos de pirona não absorvem na faixa UVA e, portanto, não podem formar ligações cruzadas com irradiação UVA adicional.
Outra característica importante dessa classe de compostos é sua capacidade de gerar oxigênio singlete , embora esse processo esteja em competição direta com a formação de adutos e possa ser uma via alternativa para a dissipação da energia do estado excitado.
A pesquisa sobre psoraleno tem se concentrado historicamente nas interações com DNA e RNA (em particular, a formação de ICL). O psoraleno, no entanto, também demonstrou bloquear a sinalização do receptor ErbB2, que é superexpresso em certos tipos agressivos de câncer de mama. Um derivado sintético do bergapteno , 5- (4-fenoxibutoxi) psoraleno, mostra-se promissor como imunossupressor por inibir um canal de potássio específico . Sua estrutura impede a intercalação em DNA e produz oxigênio singlete de maneira muito fraca, reduzindo significativamente a toxicidade indesejada e a mutagenicidade in vivo . Isso tem implicações para o tratamento de várias doenças autoimunes (por exemplo , esclerose múltipla , diabetes tipo 1 e artrite reumatóide ). Embora a modificação da superfície celular e o bloqueio do canal iônico sejam dois mecanismos de ação recém-descobertos, ainda há muita pesquisa a ser feita.
Estrutura
A maioria das furanocumarinas pode ser considerada um derivado do psoraleno ou da angelicina . O psoraleno e seus derivados são freqüentemente chamados de furanocumarinas lineares , assim chamadas por apresentarem uma estrutura química linear. Furanocumarinas lineares importantes incluem xantotoxina (também chamada de metoxsaleno ), bergapteno , imperatorina e nodakenetina .
A estrutura do psoraleno foi originalmente deduzida pela identificação dos produtos de suas reações de degradação. Exibe as reações normais da lactona da cumarina, como a abertura do anel pelo álcali para dar um ácido cumarínico ou derivado do ácido cumarínico . O permanganato de potássio causa a oxidação do anel furano, enquanto outros métodos de oxidação produzem ácido furano-2,3-carboxílico.
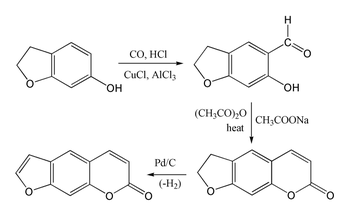
Síntese
O psoraleno é difícil de sintetizar porque a umbeliferona sofre substituição na posição 8 em vez de na posição 6 desejada. O benzofurano reage preferencialmente no anel furano em vez de no anel benzeno . No entanto, o derivado 7-hidroxi de 2,3-di-hidrobenzofurano (também chamado de cumarano) sofre substituição na posição 6 desejada, permitindo a seguinte síntese do sistema de cumarina por meio de uma reação de Gattermann-Koch seguida por uma condensação de Perkin usando anidrido acético . A síntese é então completada pela desidrogenação do anel de cinco membros para produzir o anel furano.
Biossíntese
O psoraleno se origina de cumarinas na via do shiquimato ; sua biossíntese é mostrada na figura abaixo. O anel aromático em 6 é ativado nas posições orto em relação ao grupo hidroxila e é alquilado por 5, um agente alquilante . O grupo dimetilalil em 7 então sofre ciclização com o grupo fenol para dar 8. Essa transformação é catalisada por uma monooxigenase 17 dependente do citocromo P-450 (psoraleno 5-monooxigenase), e cofatores ( NADPH ) e oxigênio molecular.
Uma via biossintética na qual o psoraleno é formado é mostrada na figura abaixo. Uma segunda enzima monooxigenase dependente de P-450 ( psoraleno sintase ) então cliva 10 (na forma de 11) de 8 para dar 1. Esta via não envolve qualquer intermediário hidroxilado, e a clivagem é postulada para ser iniciada por uma reação radical .
Fontes vegetais
Ficus carica (fig.) É provavelmente a fonte mais abundante de psoralenos. Eles também são encontrados em pequenas quantidades em Ammi visnaga (bisnaga), Pastinaca sativa (pastinaga), Petroselinum crispum ( salsa ), Levisticum officinale (lovage), Foeniculum vulgare (fruta, ou seja, sementes de funcho), Daucus carota (cenoura), Psoralea corylifolia (babchi), Apium graveolens (aipo), óleo de bergamota ( bergapten , bergamotina ).
Reparo de adutos de DNA de psoraleno
O tratamento com PUVA produz ligações cruzadas entre cadeias de DNA (ICLs) e monoadutos. Os ICLs introduzidos pelo psoraleno são altamente genotóxicos para células em replicação ativa. A ligação covalente impede a progressão da bifurcação de replicação . Portanto, é necessário desvincular o ICL antes que a replicação possa ser retomada. As etapas iniciais do reparo geralmente envolvem incisões em um fio parental em ambos os lados da reticulação. Posteriormente, o reparo da lesão pode ocorrer por um processo preciso ou impreciso.
O processo preciso para reparar ligações cruzadas é o reparo de recombinação homóloga (HRR). Isso envolve a substituição da informação danificada usando a informação intacta de outro cromossomo homólogo na mesma célula. As células de Escherichia coli deficientes em HRR são altamente sensíveis ao PUVA em comparação com as células do tipo selvagem. HRR parece ser eficiente. Em E. coli , embora uma ou duas reticulações não reparadas sejam suficientes para inativar uma célula, uma célula de tipo selvagem pode reparar e, portanto, se recuperar de 53 a 71 reticulações de psoraleno. Na levedura Saccharomyces cerevisiae, a HRR é a principal via para a remoção precisa das ligações cruzadas de psoraleno. Na levedura de tipo selvagem, os eventos de recombinação associados à remoção de reticulação por HRR são predominantemente eventos de conversão de genes não cruzados . As ligações cruzadas do psoraleno no DNA do vírus também parecem ser removidas por um processo de reparo recombinacional, como ocorre nas células infectadas com o vírus SV40 e nas células infectadas com o vírus herpes simplex.
Um processo impreciso para reparar reticulações de psoraleno parece empregar uma DNA polimerase para preencher a lacuna formada na fita com as duas incisões. Este processo é impreciso porque a fita complementar não incisada ainda retém uma parte da reticulação e, portanto, não pode servir como um modelo adequado para uma síntese de reparo precisa. A síntese imprecisa do reparo pode causar mutação . Monoadutos de psoraleno na fita de DNA modelo também podem causar desvio de replicação imprecisa ( síntese de translesão ) que pode levar à mutação. No fago T4 , o aumento na mutação observada após o tratamento com PUVA foi encontrado para refletir a síntese de translesão pela polimerase de DNA de tipo selvagem, provavelmente devido à capacidade de leitura de prova imperfeita.
Análise de estruturas de ácidos nucléicos
Os psoralenos podem fazer ligações cruzadas reversíveis de ácidos nucléicos em hélices duplas e, portanto, têm sido amplamente usados para a análise de interações e estruturas de DNA e RNA.
Referências
Leitura adicional
- Dean, FM (1963). Compostos do anel de oxigênio de ocorrência natural . Londres: Butterworths.
- The Merck Index (7ª ed.). Rahway NJ: Merck. 1960