Clorocromato de piridínio - Pyridinium chlorochromate
|
|||
|
|
|||
| Nomes | |||
|---|---|---|---|
|
Nome IUPAC
Clorocromato de piridínio
|
|||
| Outros nomes
PCC; Reagente Corey-Suggs
|
|||
| Identificadores | |||
|
Modelo 3D ( JSmol )
|
|||
| ChEBI | |||
| ChemSpider | |||
| ECHA InfoCard |
100.043.253 |
||
| Número EC | |||
|
PubChem CID
|
|||
| UNII | |||
|
Painel CompTox ( EPA )
|
|||
|
|||
|
|||
| Propriedades | |||
| C 5 H 6 ClCrNO 3 | |||
| Massa molar | 215,56 g / mol | ||
| Aparência | sólido amarelo-laranja | ||
| Ponto de fusão | 205 ° C (401 ° F; 478 K) | ||
| Solubilidade em outros solventes | solúvel em acetona , acetonitrila , THF | ||
| Perigos | |||
| Riscos principais | Carcinógeno suspeito e poluente ambiental | ||
| Ficha de dados de segurança | SDS externo | ||
| Pictogramas GHS |
   
|
||
| Palavra-sinal GHS | Perigo | ||
| H350 , H272 , H317 , H410 | |||
| P201 , P280 , P273 , P221 , P308 + 313 , P302 + 352 | |||
| NFPA 704 (diamante de fogo) | |||
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|||
|
|
|||
| Referências da Infobox | |||
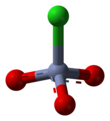
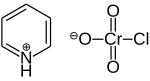
O clorocromato de piridínio ( PCC ) é um sal amarelo-laranja com a fórmula [C 5 H 5 NH] + [CrO 3 Cl] - . É um reagente em síntese orgânica usado principalmente para oxidação de álcoois para formar carbonilos . Uma variedade de compostos relacionados são conhecidos com reatividade semelhante. O PCC oferece a vantagem da oxidação seletiva de álcoois em aldeídos ou cetonas, enquanto muitos outros reagentes são menos seletivos.
Estrutura e preparação
O PCC consiste em um cátion piridínio , [C 5 H 5 NH] + , e um ânion clorocromato tetraédrico, [CrO 3 Cl] - . Sais relacionados também são conhecidos, tais como clorocromato de 1-butilpiridínio, [C 5 H 5 N (C 4 H 9 )] [CrO 3 Cl] e clorocromato de potássio .
PCC está disponível comercialmente. Descoberto por acidente, o reagente foi originalmente preparado por meio da adição de piridina em uma solução fria de trióxido de cromo em ácido clorídrico concentrado :
- C 5 H 5 N + HCl + CrO 3 → [C 5 H 5 NH] [CrO 3 Cl]
Em um método alternativo, a formação de fumaça de cloreto de cromila (CrO 2 Cl 2 ) durante a fabricação da solução mencionada foi minimizada simplesmente alterando a ordem de adição: uma solução fria de piridina em ácido clorídrico concentrado foi adicionada ao trióxido de cromo sólido sob agitação .
Usos
Oxidação de álcoois
O PCC é usado como oxidante . Em particular, provou ser altamente eficaz na oxidação de álcoois primários e secundários em aldeídos e cetonas , respectivamente. O reagente é mais seletivo do que o reagente de Jones relacionado , portanto, há pouca chance de superoxidação para formar ácidos carboxílicos, desde que não haja água na mistura de reação. Uma oxidação típica de PCC envolve a adição de um álcool a uma suspensão de PCC em diclorometano . A reação geral é:
- 2 [C 5 H 5 NH] [CrO 3 Cl] + 3 R 2 CHOH → 2 [C 5 H 5 NH] Cl + Cr 2 O 3 + 3 R 2 C = O + 3 H 2 O
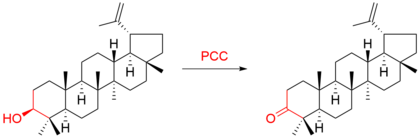
Por exemplo, o triterpeno lupeol foi oxidado a lupenona :
Oxidação de Babler
Com álcoois terciários, o éster de cromato formado a partir do PCC pode isomerizar por meio de uma reação [3,3] -sigmatrópica e após a oxidação produzir uma enona, em uma reação conhecida como oxidação de Babler :
Este tipo de reação de transposição oxidativa tem sido utilizado sinteticamente, por exemplo , para a síntese de morfina .
Usar outros oxidantes comuns no lugar do PCC geralmente leva à desidratação, porque esses álcoois não podem ser oxidados diretamente.
Outras reações
O PCC também converte álcoois insaturados e aldeídos adequados em ciclohexenonas . Esta via, uma ciclização catiônica oxidativa , é ilustrada pela conversão de (-) - citronelol em (-) - pulegona .
O PCC também efetua oxidações alílicas , por exemplo, na conversão de diidrofuranos em furanonas .
Reagentes relacionados
Outros reagentes mais convenientes ou menos tóxicos para oxidar álcoois incluem dimetilsulfóxido , que é usado nas oxidações de Swern e Pfitzner-Moffatt , e compostos hipervalentes de iodo , como o periodinano de Dess-Martin .
Segurança
Uma desvantagem do uso do PCC é sua toxicidade, que compartilha com outros compostos de cromo hexavalente .
Veja também
Referências
Leitura adicional
- Tojo, G .; Fernández, M. (2006). Tojo, G. (ed.). Oxidação de Álcoois em Aldeídos e Cetonas: Um Guia para a Prática Comum Atual . Reações básicas em síntese orgânica. Nova York: Springer . ISBN 978-0-387-23607-0.
links externos
- Suplemento de Monografias IARC 7, Cromo e Compostos de Cromo
- História do PCC
- Inventário Nacional de Poluentes, Fichas Técnicas de Compostos de Cromo (VI)
≠ × ÷ ň