Hexafluoreto de ródio - Rhodium hexafluoride
|
|
| Nomes | |
|---|---|
|
Nome IUPAC
fluoreto de ródio (VI)
|
|
| Outros nomes
hexafluoreto de ródio
|
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
|
PubChem CID
|
|
|
Painel CompTox ( EPA )
|
|
|
|
|
|
| Propriedades | |
| F 6 Rh | |
| Massa molar | 216,91 g / mol |
| Aparência | sólido cristalino preto |
| Densidade | 3,71g / mL |
| Ponto de fusão | ≈ 70 ° C (158 ° F; 343 K) |
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|
| Referências da Infobox | |
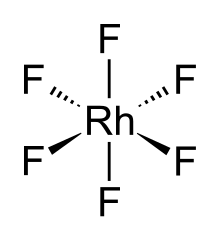
Hexafluoreto de ródio , também fluoreto de ródio (VI) , (RhF 6 ) é o composto inorgânico de ródio e flúor . Um sólido volátil preto, é um material altamente reativo e um exemplo raro de um composto de ródio (VI). É um dos dezessete hexafluoretos binários conhecidos .
Síntese, estrutura, propriedades
O hexafluoreto de ródio é preparado pela reação do metal ródio com um excesso de flúor elementar :
- Rh + 3 F 2 → RhF 6
A molécula RhF 6 possui geometria molecular octaédrica . Consistente com sua configuração d 3 , os seis comprimentos de ligação Rh – F são equivalentes, sendo 1,824 Å. Ele se cristaliza em um grupo espacial ortorrômbico Pnma com parâmetros de rede de a = 9,323 Å , b = 8,474 Å e c = 4,910 Å.
Como alguns outros fluoretos de metal, RhF 6 é altamente oxidante. Ele ataca até mesmo o vidro, mesmo na ausência de água. Ele pode até reagir com o oxigênio elementar .
Referências
- ^ a b c CRC Handbook of Chemistry and Physics , 90th Edition, CRC Press, Boca Raton, Florida, 2009, ISBN 978-1-4200-9084-0 , Section 4, Physical Constants of Inorganic Compounds , p. 4-85.
- ^ a b Drews, T .; Supel, J .; Hagenbach, A .; Seppelt, K. (2006). "Estruturas moleculares de estado sólido de hexafluoretos de metais de transição". Química Inorgânica . 45 (9): 3782–3788. doi : 10.1021 / ic052029f . PMID 16634614 .
- ^ a b 《无机 化学 丛书》 第九卷 : 锰 分 族 、 铁 系 、 铂 系 (em chinês). 北京: 科学 出版社. p. 478. ISBN 7-03-002238-6 .
- ^ Riedel, Sebastian; Kaupp, Martin (2009). "Os mais altos estados de oxidação dos elementos de metal de transição" (PDF) . Revisões de Química de Coordenação . Elsevier. 253 (5–6): 606–624. doi : 10.1016 / j.ccr.2008.07.014 .
Leitura adicional
- Gmelins Handbuch der anorganischen Chemie , System Nr. 63, Rhodium, Part B1, pp. 266-268.
