Óxido de rutênio (IV) - Ruthenium(IV) oxide
|
|
| Nomes | |
|---|---|
|
Nome IUPAC
Óxido de rutênio (IV)
|
|
| Outros nomes
Dióxido de rutênio
|
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| ECHA InfoCard |
100.031.660 |
| Número EC | |
|
PubChem CID
|
|
|
Painel CompTox ( EPA )
|
|
|
|
|
|
| Propriedades | |
| RuO 2 | |
| Massa molar | 133,0688 g / mol |
| Aparência | sólido preto-azulado |
| Densidade | 6,97 g / cm 3 |
| Ponto de ebulição | 1.200 ° C (2.190 ° F; 1.470 K) sublimados |
| insolúvel | |
| + 162,0 · 10 −6 cm 3 / mol | |
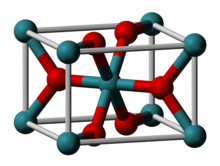
| Estrutura | |
| Rutilo (tetragonal), tP6 | |
| P 4 2 / mnm , No. 136 | |
| Octaédrico (Ru IV ); planar trigonal (O 2− ) | |
| Perigos | |
| Ficha de dados de segurança | Veja: página de dados |
| Ponto de inflamação | Não inflamável |
| Compostos relacionados | |
|
Outros ânions
|
Dissulfeto de rutênio |
|
Outros cátions
|
Óxido de ósmio (IV) |
| Tetróxido de rutênio | |
| Página de dados suplementares | |
|
Índice de refração ( n ), constante dielétrica (ε r ), etc. |
|
|
Dados termodinâmicos |
Comportamento da fase sólido-líquido-gás |
| UV , IR , NMR , MS | |
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Referências da Infobox | |
O óxido de rutênio (IV) é o composto inorgânico com a fórmula Ru O 2 . Este sólido preto é o óxido de rutênio mais comum . É amplamente utilizado como eletrocatalisador para a produção de cloro, óxidos de cloro e o catalisador de O 2 é o óxido de rutênio (IV). Como muitos dióxidos, RuO 2 adota a estrutura de rutilo .
Preparação
Geralmente é preparado pela oxidação do tricloreto de rutênio . Cristais únicos quase estequiométricos de RuO 2 podem ser obtidos por transporte de vapor químico , usando O 2 como o agente de transporte:
- RuO 2 + O 2 ⇌ RuO 4
Filmes de RuO 2 podem ser preparados por deposição química de vapor (CVD) a partir de compostos voláteis de rutênio. O RuO 2 também pode ser preparado por eletrodeposição a partir de uma solução de tricloreto de rutênio.
Hidrossóis estabilizados eletrostaticamente de hidrato de dióxido de rutênio puro foram preparados explorando a redução autocatalítica de tetróxido de rutênio em solução aquosa. As populações de partículas resultantes podem ser controladas para compreender esferas uniformes substancialmente monodispersas com diâmetros na faixa de 40nm - 160nm.
Usos
O óxido de rutênio (IV) está sendo usado como o principal componente no catalisador do processo Sumitomo- Deacon, que produz cloro pela oxidação do cloreto de hidrogênio .
O RuO 2 pode ser usado como catalisador em muitas outras situações. As reações dignas de nota são o processo Fischer-Tropsch , o processo Haber-Bosch e várias manifestações das células de combustível .
Aplicações potenciais e de nicho
O RuO 2 é amplamente utilizado para o revestimento de ânodos de titânio para a produção eletrolítica de cloro e para a preparação de resistores ou circuitos integrados . Os resistores de óxido de rutênio podem ser usados como termômetros sensíveis na faixa de temperatura 0,02 <T <4 K. Ele também pode ser usado como material ativo no supercapacitor porque tem uma capacidade de transferência de carga muito alta. O óxido de rutênio tem grande capacidade de armazenar carga quando usado em soluções aquosas. As capacidades médias de óxido de rutênio (IV) atingiram 650 F / g quando em solução de H 2 SO 4 e recozido em temperaturas abaixo de 200 ° C. Na tentativa de otimizar suas propriedades capacitivas, trabalhos anteriores examinaram a hidratação do óxido de rutênio, sua cristalinidade e tamanho de partícula.
