Reagente de Schwartz - Schwartz's reagent

|
|
|
|
| Nomes | |
|---|---|
|
Nome IUPAC
Cloridohidridozirconoceno
|
|
|
Nome IUPAC sistemático
cloridobis (η 5- ciclopentadienil) hidridozircônio |
|
| Outros nomes
Cp 2 ZrClH, hidreto de cloreto de zirconoceno
|
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| ChemSpider | |
| ECHA InfoCard |
100.048.599 |
| Número EC | |
|
PubChem CID
|
|
| UNII | |
|
Painel CompTox ( EPA )
|
|
|
|
|
|
| Propriedades | |
| C 10 H 11 ClZr | |
| Massa molar | 257,87 g / mol |
| Aparência | Sólido branco |
| Perigos | |
| Pictogramas GHS |
 
|
| Palavra-sinal GHS | Perigo |
| H228 , H261 , H314 | |
| P210 , P231 + 232 , P240 , P241 , P260 , P264 , P280 , P301 + 330 + 331 , P303 + 361 + 353 , P304 + 340 , P305 + 351 + 338 , P310 , P321 , P363 , P370 + 378 , P402 + 404 , P405 , P501 | |
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Referências da Infobox | |
O reagente de Schwartz é o nome comum para o composto de organozircônio com a fórmula (C 5 H 5 ) 2 ZrHCl, às vezes chamado de cloridrato de zirconoceno ou hidreto de cloreto de zirconoceno , e tem o nome de Jeffrey Schwartz, professor de química da Universidade de Princeton . Este metaloceno é usado em síntese orgânica para várias transformações de alcenos e alcinos .
Preparação
O complexo foi preparado pela primeira vez na forma bruta por Wailes e Weigold. Pode ser adquirido ou prontamente preparado por redução de dicloreto de zirconoceno com hidreto de alumínio e lítio :
- (C 5 H 5 ) 2 ZrCl 2 + 1 / 4 LiAlH 4 → (C 5 H 5 ) 2 ZrHCl + 1 / 4 LiAlCl 4
Na prática, esta reação também fornece (C 5 H 5 ) 2 ZrH 2 , que é tratado com cloreto de metileno para dar o cloreto de hidreto misto. Um procedimento alternativo que gerou o reagente de Schwartz a partir de diidrido também foi relatado.
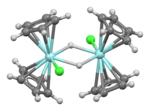
Estrutura
A estrutura dimetálica foi confirmada por MicroED . Os resultados são consistentes com a espectroscopia FT-IR , que estabeleceu que os hidretos estão em ponte. A espectroscopia de NMR de estado sólido também indica uma estrutura dimérica. A estrutura cristalográfica de raios-X para o composto de metila (C 5 H 5 ) 4 Zr 2 H 2 (CH 3 ) 2 é análoga.
Usos em síntese orgânica
O reagente de Schwartz pode ser usado para várias reações. Foi demonstrado que pode ser usado para reduzir amidas a aldeídos . Reduzir as amidas terciárias com o reagente de Schwartz pode atingir rendimentos eficientes, mas as amidas primárias e secundárias apresentarão rendimentos reduzidos. O uso do reagente de Schwartz dessa maneira não requer nenhum aquecimento adicional e pode ser feito rapidamente, e a redução da forma de álcool não é uma reação colateral problemática como pode ser com outros agentes redutores . O reagente de Schwartz reduzirá seletivamente a amida em relação a quaisquer ésteres prontamente redutíveis que possam estar presentes na mistura de reação.
A vinilação de cetonas em altos rendimentos é um uso possível do reagente de Schwartz.
O reagente de Schwartz é usado na síntese de alguns antibióticos macrolídeos , (-) - motuporina e agentes antitumorais.
Hidrozirconação
A hidrozirconação é uma forma de hidrometalação . Os substratos para a hidrozirconação são alcenos e alcinos . Com alcinos terminais, o produto terminal de vinil zircônio é predominantemente formado. As reações secundárias são adições nucleofílicas , transmetalações , adições de conjugados , reações de acoplamento , carbonilação e halogenação .
Estudos computacionais indicam que a hidrosirconação ocorre a partir da porção interior. Quando tratado com um equivalente de Cp 2 ZrClH, difenilacetileno dá o alquenilzircônio correspondente como uma mistura de isômeros cis e trans . Com dois equivalentes de hidreto, o produto final era uma mistura de eritro e treo zircono alcanos:
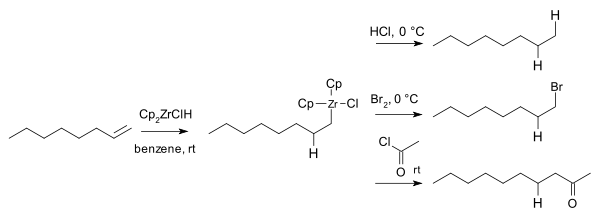
Em 1974, Hart e Schwartz relataram que os intermediários de organozircônio reagem com eletrófilos , como ácido clorídrico , bromo e cloretos de ácido para dar o alcano , bromoalcanos e cetonas correspondentes :
Os compostos de organoboro e organoalumínio correspondentes já eram conhecidos, mas estes são sensíveis ao ar e / ou pirofóricos, enquanto os compostos de organozircônio não são.
Escopo
Em um estudo a habitual regiosselectividade de um hydrozirconation alcino é revertido com a adição de cloreto de zinco :
Um exemplo de um acoplamento de hidrozirconação em um único recipiente - carbonilação - é descrito abaixo:
Com certos álcoois alílicos , o grupo álcool é substituído por carbono nucleofílico formando um anel ciclopropano : A seletividade da hidrozirconação de alcinos foi estudada em detalhes. Geralmente, a adição de Zr-H prossegue por meio da adição syn . A taxa de adição de ligações insaturadas carbono-carbono é alcino terminal> alceno terminal ≈ alcino interno> alceno dissubstituído Os complexos de acila podem ser gerados pela inserção de CO na ligação C-Zr resultante da hidrozirconação. Após a inserção do alqueno na ligação de hidreto de zircônio, o alquil de zircônio resultante sofre um rearranjo fácil para o alquil terminal e, portanto, apenas os compostos acil terminais podem ser sintetizados desta forma. O rearranjo provavelmente prossegue por meio da eliminação de β-hidreto seguida de reinserção.
Leitura adicional
- Hart, DW; Schwartz, J. (1974). "Hydrozirconation. Organic Synthesis via Organozirconium Intermediates. Synthesis and Rearrangement of Alkylzirconium (IV) Complexes and Your Reaction with Electrophiles". Geléia. Chem. Soc. 96 (26): 8115–8116. doi : 10.1021 / ja00833a048 .
- Schwartz, J .; Labinger, JA (2003). "Hydrozirconation: A New Transition Metal Reagent for Organic Synthesis". Angew. Chem. Int. Ed. 15 (6): 330–340. doi : 10.1002 / anie.197603331 .
- Hart, Donald W .; Blackburn, Thomas F .; Schwartz, Jeffrey (1975). "Hydrozirconation. III. Funcionalização estereoespecífica e regiosseletiva de alquilacetilenos via intermediários de vinilzircônio (IV)". Geléia. Chem. Soc. 97 (3): 679–680. doi : 10.1021 / ja00836a056 .
Referências
links externos
- Exemplos em síntese orgânica no site da Universidade de Connecticut