Di-hidroxilação assimétrica de Sharpless - Sharpless asymmetric dihydroxylation
| Di-hidroxilação assimétrica de Sharpless | |
|---|---|
| nomeado após | Barry Sharpless |
| tipo de reacção | reacção de adição |
| identificadores | |
| Portal Organic Chemistry | Sharpless-di-hidroxilação |
| RSC ID ontologia | RXNO: 0000142 |
Di-hidroxilação assimétrica de Sharpless (também chamado o bishydroxylation Sharpless ) é a reacção química de um alceno com tetróxido de ósmio na presença de um quiral quinina ligando para formar um vicinal diol .
É prática comum para realizar esta reacção utilizando uma quantidade catalítica de tetróxido de ósmio, que após a reacção é regenerado com qualquer ferricianeto de potássio ou N -metilmorfolina N -óxido . Isto reduz dramaticamente a quantidade da altamente tóxico tetróxido de ósmio e muito caro necessário. Estes quatro reagentes estão disponíveis comercialmente pré-misturados ( " AD-mix "). A mistura contendo (DHQ) 2 PHAL é chamado de AD-mix-α, e a mistura contendo o (DHQD) 2 -PHAL é chamado de AD-mix-β.
Tais dióis quirais são importantes na síntese orgânica . A introdução de quiralidade em nonchiral reagentes através do uso de quirais catalisadores é um conceito importante na síntese orgânica . Esta reação foi desenvolvido principalmente por K. Barry Sharpless edifício no já conhecido racêmica diidroxilação Upjohn , para o qual ele foi premiado com uma quota de 2001 Prêmio Nobel de Química .
Conteúdo
fundo
Dihidroxilação alceno por tetróxido de ósmio é um método antigo e extremamente útil para a funcionalização de olefinas. No entanto, uma vez que de ósmio (VIII) Os reagentes tais como tetróxido de ósmio (OsO 4 ) são caros e extremamente tóxico, tornou-se desejável desenvolver variantes catalíticos da presente reacção. Alguns terminais oxidantes estequiométricos que foram utilizados nestas reacções catalíticas incluem clorato de potássio , peróxido de hidrogénio ( Milas hidroxilação ), N -metilmorfolina N -óxido (NMO, Upjohn di-hidroxilação ), terc hidroperóxido de butilo ( t BHP), e ferricianeto de potássio (K 3 Fe (CN) 6 ). K. Barry Sharpless foi o primeiro a desenvolver um, confiável geral enantiosseletivos diidroxilação alceno, referido como o Sharpless Asymmetric diidroxilação (SAD). Os baixos níveis de OsO 4 são combinados com um oxidante ferricianeto estequiométrico na presença de ligandos azotados quirais para criar um ambiente assimétrico em torno do oxidante.
mecanismo de reacção
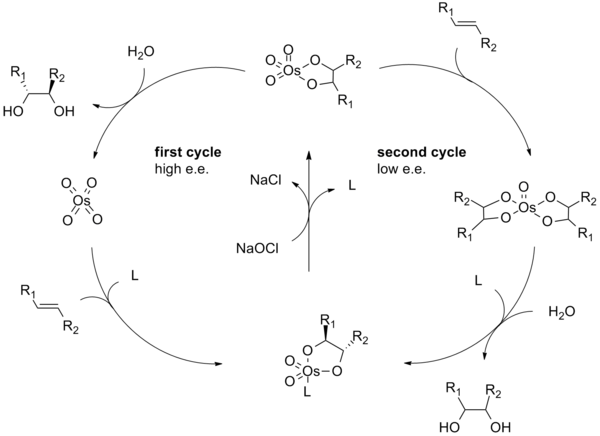
O mecanismo de reacção da di-hidroxilação de Sharpless começa com a formação do tetróxido de ósmio - complexo de ligando ( 2 ). A [3 + 2] -cycloaddition com o alceno ( 3 ) dá o intermediário cíclico 4 . Básico hidrólise liberta o diol ( 5 ) e o osmato reduzida ( 6 ). Finalmente, o estequiométrica oxidante regenera o tetróxido de ósmio - complexo de ligando ( 2 ).
O mecanismo da Sharpless assimétrica dihidroxilação tem sido extensivamente estudada e um potencial ciclo catalítico secundário foi identificado (ver abaixo). Se o éster osmylate intermediário é oxidado antes de ele dissocia-se, em seguida, uma de ósmio (VIII) -diol complexo é formado o qual pode, em seguida, dihydroxylate outro alceno. Dihydroxylations resultantes desta via secundária geralmente sofrem enantiosselectividades baixas do que as que resultam da via principal. Um diagrama esquemático que mostra esta via catalítica secundário é mostrado abaixo. Esta via secundária pode ser suprimida através da utilização de uma concentração molar mais elevada de ligando.
Estudos mecanicistas
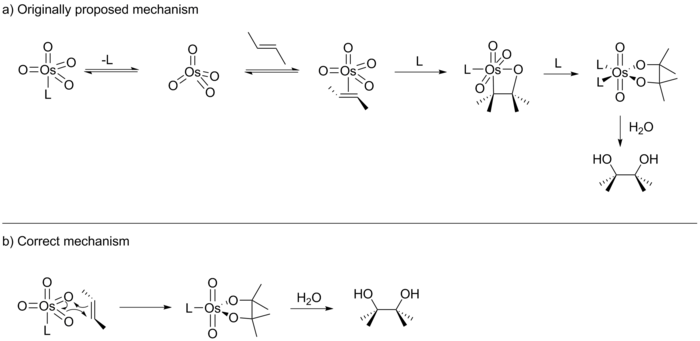
O mecanismo preciso da reacção de dihidroxilação assimétrica Sharpless era um problema muito debatido. O TAS foi relatada pela primeira vez por K. Barry Sharpless em 1980, e no seu relatório original Sharpless sugeriu que a reacção prosseguiu através de uma [2 + 2] cicloadição de OsO 4 para o alceno para dar um intermediário osmaoxetane (ver abaixo). Este intermediário, então, submeter-se a uma inserção migratório 1,1- para formar um éster osmylate que após a hidrólise se dá o correspondente diol. Em 1989 EJ Corey publicada uma variante ligeiramente diferente desta reacção e sugeriu que a reacção prosseguiu muito provavelmente através de uma cicloadição [3 + 2] de OsO 4 com o alceno para gerar directamente o éster osmylate. Sugestão de Corey foi baseado em um estudo computacional anterior realizado por Jorgensen e Hoffman, que determinou o [3 + 2] via de reacção a ser a via de menor energia. Além disso Corey fundamentado que repulsões estéricas no intermediário octaédrica seria desfavorecer a via de [2 + 2].
Os próximos dez anos viu inúmeras publicações por ambos Corey e Sharpless, cada um apoiando a sua própria versão do mecanismo. Embora esses estudos não foram capazes de distinguir entre as duas vias de ciclização proposto, eles foram bem sucedidos em lançar luz sobre o mecanismo de outras maneiras. Por exemplo, de Sharpless fornecida evidência para a reacção de prosseguir através de um mecanismo de passo a passo. Além disso, tanto Sharpless e Corey mostrou que o catalisador activo possui uma bolsa de ligao quiral em forma de U. Corey também mostrou que o catalisador obedece cinica de Michaelis-Menten e actua como uma enzima de bolso com um pré-equilíbrio. Na edição do Journal of the American Chemical Society Sharpless fevereiro 1997 publicou os resultados de um estudo (a análise Hammett), que ele alegou apoiou um [2 + 2] ciclização sobre a [3 + 2]. Em Outubro de emissão do mesmo ano, no entanto, de Sharpless também publicaram os resultados de um outro estudo conduzido em colaboração com Ken Houk e Singleton que proporcionou provas conclusivas para o mecanismo de [3 + 2]. Assim Sharpless foi forçado a admitir o debate de uma década.
Estrutura catalisador

Evidência cristalográfica revelou que o catalisador activo possui uma espécie de ósmio pentacoordinate realizada em uma bolsa de ligao em forma de L. O ligando azotado prende OsO 4 em um ambiente quiral fazendo abordagem de um lado da olefina estericamente impedida, enquanto o outro não é.
sistemas catalíticos
Numerosos sistemas catalíticos e modificações têm sido desenvolvidos para o DAU. Dada a seguir é uma breve visão geral dos vários componentes do sistema catalítico:
- Oxidante catalítica: Este é sempre OsO 4 , no entanto, certos aditivos podem coordenar ao de ósmio (VIII) e modificar as suas propriedades electrónicas. OsO 4 é muitas vezes gerado in situ a partir de K 2 OsO 2 (OH) 4 (um sistema operacional (VI) espécies) devido a preocupações de segurança.
- Quiral auxiliar: Este é geralmente algum tipo de alcalóide quina.
- Oxidante estequiométrico:
- Peróxidos estavam entre os primeiros oxidantes estequiométricos para ser utilizadas neste ciclo catalítico; ver a hidroxilação Milas . Inconvenientes de peróxidos incluem questões quimiosseletividade.
- N-óxidos de trialquilamónio, tal como NMO-como na Reacção Upjohn -e N-óxido de trimetilamina.
- Ferricianeto de potsio (K 3 Fe (CN) 6 ) é o oxidante estequiométrico mais comumente utilizado para a reacção, e é o oxidante que entra na preparação AD-mix disponíveis comercialmente.
- Aditivo:
- Ácido cítrico: tetróxido de ósmio é um oxidante electrof e, como tal, reage lentamente com olefinas deficientes em electrões. Verificou-se que a taxa de oxidação de olefinas deficientes em electrões pode ser acelerada através da manutenção do pH da reacção ligeiramente acídica. Por outro lado, um pH elevado pode aumentar a taxa de oxidação de olefinas internas, e também aumentar o excesso enantiomérico (ee) para a oxidação de olefinas terminais.
regiosseletividade
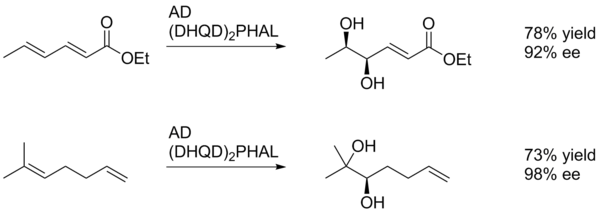
Em di-hidroxilação assimétrica de Sharpless geral favorece a oxidação do alqueno rico em electrões mais (esquema 1).
Neste exemplo SAD dá o diol do alceno mais próximo para o grupo para-metoxibenzoil (de remoção de electrões), embora com um rendimento baixo. Isto é provavelmente devido à capacidade do anel de arilo para interagir favoravelmente com o local activo do catalisador através π-empilhamento. Desta maneira, o substituinte arilo pode actuar como um grupo director.
estereoseletividade
A diastereo-selectividade da SAD é constituída, principalmente pela escolha de ligando (ou seja AD-mix-α contra AD-mix-β), no entanto, factores tais como a quiralidade pré-existentes no substrato ou grupos funcionais vizinhos podem também desempenhar um papel. No exemplo mostrado abaixo, o substituinte para-metoxibenzoil serve principalmente como uma fonte de grandes quantidades estérica para permitir que o catalisador para diferenciar as duas faces do alceno.
É muitas vezes difícil de obter alta diastereosselectividade no cis-alcenos, quando ambos os lados da olefina tem ambientes esticos similares.
Aplicação
Em comparação com a reacção com uma quantidade estequiométrica de ósmio, o catalítica, di-hidroxilação assimétrica reduz o custo deste procedimento de 99,9%, de abrir a porta para avanços na osmates biomiméticos e simpáticos.
di-hidroxilação assimétrica foi aplicado a alcenos de cada substituição, e altos enantiosseletividades foram realizados para cada padrão de substituição. reacções de di-hidroxilação assimétrica também são altamente selectivos local, proporcionando produtos derivados a partir da reacção da ligação dupla mais rico em electrões no substrato.
Veja também
- oxidação catalítica assimétrica
- Milas hidroxilação
- Upjohn diidroxilação
- Sharpless aminohydroxylation