Cloreto de sódio -Sodium chloride
 Cristais de cloreto de sódio em forma de halita
|
|
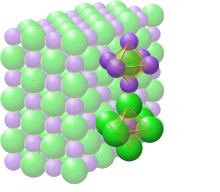
 Estrutura cristalina com sódio em roxo e cloreto em verde
|
|
| nomes | |
|---|---|
|
nome IUPAC
Cloreto de Sódio
|
|
| Outros nomes
|
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| 3534976 | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| ECHA InfoCard | 100.028.726 |
| Número CE | |
| 13673 | |
| KEGG | |
| Malha | Sódio+cloreto |
|
PubChem CID
|
|
| número RTECS | |
| UNII | |
|
Painel CompTox ( EPA )
|
|
|
|
|
|
| Propriedades | |
| NaCl | |
| Massa molar | 58,443 g/mol |
| Aparência | Cristais cúbicos incolores |
| Odor | Inodoro |
| Densidade | 2,17 g/ cm3 |
| Ponto de fusão | 800,7 °C (1.473,3 °F; 1.073,8 K) |
| Ponto de ebulição | 1.465 °C (2.669 °F; 1.738 K) |
| 360 g/1000 g de água pura a T = 25 °C | |
| Solubilidade em amônia | 21,5 g/L em T = ? |
| Solubilidade em metanol | 14,9 g/L em T = ? |
| −30,2·10 −6 cm 3 /mol | |
|
Índice de refração ( n D )
|
1,5441 (a 589 nm) |
| Estrutura | |
| Cúbico de face centrada ( ver texto ), cF8 |
|
| Fm 3 m (nº 225) | |
|
a = 564,02 pm
|
|
|
Unidades de fórmula ( Z )
|
4 |
| octaédrica em Na + octaédrica em Cl − |
|
| Termoquímica | |
|
Capacidade térmica ( C )
|
50,5 J/(K·mol) |
|
Entropia molar padrão ( S ⦵ 298 ) |
72,10 J/(K·mol) |
|
Std entalpia de
formação (Δ f H ⦵ 298 ) |
−411,120 kJ/mol |
| Farmacologia | |
| A12CA01 ( OMS ) B05CB01 ( OMS ), B05XA03 ( OMS ), S01XA03 ( OMS ) | |
| Perigos | |
| NFPA 704 (diamante de fogo) | |
| Dose letal ou concentração (LD, LC): | |
|
LD 50 ( dose mediana )
|
3 g/kg (oral, ratos) |
| compostos relacionados | |
|
Outros ânions
|
Fluoreto de sódio Brometo de sódio Iodeto de sódio Astatídeo de sódio |
|
Outros cátions
|
Cloreto de lítio Cloreto de potássio Cloreto de rubídio Cloreto de césio Cloreto de frâncio |
| Página de dados suplementares | |
| Cloreto de sódio (página de dados) | |
|
Exceto quando indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 °C [77 °F], 100 kPa).
|
|
Cloreto de sódio / ˌ s oʊ d i ə m ˈ k l ɔːr aɪ d / , comumente conhecido como sal (embora o sal marinho também contenha outros sais químicos ), é um composto iônico com a fórmula química NaCl , representando uma proporção de 1:1 de íons sódio e cloreto . Com massas molares de 22,99 e 35,45 g/mol, respectivamente, 100 g de NaCl contém 39,34 g de Na e 60,66 g de Cl. O cloreto de sódio é o sal mais responsável pela salinidade da água do mar e do fluido extracelular de muitos organismos multicelulares . Em sua forma comestível, o sal (também conhecido como sal de mesa ) é comumente usado como condimento e conservante de alimentos . Grandes quantidades de cloreto de sódio são usadas em muitos processos industriais, e é uma importante fonte de compostos de sódio e cloro usados como matérias- primas para outras sínteses químicas . Outra aplicação importante do cloreto de sódio é o degelo de estradas em clima subcongelante.
Usos
Além dos usos domésticos familiares do sal, as aplicações mais dominantes da produção de aproximadamente 250 milhões de toneladas por ano (dados de 2008) incluem produtos químicos e degelo.
funções químicas
O sal é usado, direta ou indiretamente, na produção de muitos produtos químicos, que consomem a maior parte da produção mundial.
indústria de cloro-álcalis
É o ponto de partida para o processo cloralcalino , processo industrial de produção de cloro e hidróxido de sódio , segundo a equação química
Essa eletrólise é conduzida em uma célula de mercúrio, uma célula de diafragma ou uma célula de membrana. Cada um deles usa um método diferente para separar o cloro do hidróxido de sódio. Outras tecnologias estão em desenvolvimento devido ao alto consumo de energia da eletrólise, onde pequenas melhorias na eficiência podem ter grandes retornos econômicos. Algumas aplicações de cloro incluem a produção de termoplásticos de PVC , desinfetantes e solventes.
O hidróxido de sódio é amplamente utilizado em muitas indústrias diferentes, permitindo a produção de papel, sabão e alumínio, etc.
indústria de carbonato de sódio
O cloreto de sódio é usado no processo Solvay para produzir carbonato de sódio e cloreto de cálcio . O carbonato de sódio, por sua vez, é usado para produzir vidro , bicarbonato de sódio e corantes , além de uma infinidade de outros produtos químicos. No processo de Mannheim , o cloreto de sódio é usado para a produção de sulfato de sódio e ácido clorídrico .
Padrão
O cloreto de sódio tem um padrão internacional criado pela ASTM International . O padrão é denominado ASTM E534-13 e é o método de teste padrão para análise química de cloreto de sódio. Esses métodos listados fornecem procedimentos para análise de cloreto de sódio para determinar se ele é adequado para o uso e aplicação pretendidos.
Usos industriais diversos
O cloreto de sódio é muito usado, portanto, mesmo aplicações relativamente pequenas podem consumir grandes quantidades. Na exploração de petróleo e gás , o sal é um componente importante dos fluidos de perfuração na perfuração de poços. Ele é usado para flocular e aumentar a densidade do fluido de perfuração para superar altas pressões de gás no fundo do poço. Sempre que uma broca atinge uma formação de sal, o sal é adicionado ao fluido de perfuração para saturar a solução a fim de minimizar a dissolução dentro do estrato salino. O sal também é usado para aumentar a cura do concreto em revestimentos cimentados.
Em têxteis e tingimento, o sal é usado como enxágue de salmoura para separar contaminantes orgânicos, para promover a "salagem" de precipitados de corantes e para misturar com corantes concentrados para padronizá-los. Uma de suas principais funções é fornecer a carga iônica positiva para promover a absorção de íons carregados negativamente dos corantes.
Também é usado no processamento de alumínio , berílio , cobre , aço e vanádio . Na indústria de celulose e papel , o sal é usado para branquear a polpa de madeira. Também é usado para fazer clorato de sódio , que é adicionado junto com ácido sulfúrico e água para fabricar dióxido de cloro , um excelente produto químico de branqueamento à base de oxigênio. O processo de dióxido de cloro, que se originou na Alemanha após a Primeira Guerra Mundial, está se tornando mais popular por causa das pressões ambientais para reduzir ou eliminar os compostos de branqueamento clorados. No curtimento e tratamento de couro, o sal é adicionado às peles de animais para inibir a atividade microbiana na parte inferior das peles e para atrair a umidade de volta para as peles.
Na fabricação de borracha, o sal é usado para fazer buna , neoprene e tipos de borracha branca. Salmoura e ácido sulfúrico são usados para coagular um látex emulsionado feito de butadieno clorado .
O sal também é adicionado para proteger o solo e dar firmeza ao alicerce sobre o qual as estradas são construídas. O sal atua para minimizar os efeitos do deslocamento causado no subsolo por mudanças na umidade e carga de tráfego.
O cloreto de sódio às vezes é usado como um dessecante barato e seguro por causa de suas propriedades higroscópicas , tornando historicamente a salga um método eficaz de preservação de alimentos ; o sal extrai água das bactérias por pressão osmótica , impedindo-as de se reproduzir, uma das principais fontes de deterioração dos alimentos. Embora dessecantes mais eficazes estejam disponíveis, poucos são seguros para a ingestão humana.
amaciamento de água
A água dura contém íons de cálcio e magnésio que interferem na ação do sabão e contribuem para o acúmulo de incrustações ou película de depósitos minerais alcalinos em equipamentos e tubulações domésticas e industriais. Unidades de amaciamento de água comerciais e residenciais usam resinas de troca iônica para remover os íons que causam a dureza. Essas resinas são geradas e regeneradas usando cloreto de sódio.
Sal da estrada
A segunda maior aplicação de sal é para degelo e antigelo de estradas, tanto em lixeiras quanto espalhado por veículos de serviço de inverno . Em antecipação à queda de neve, as estradas são otimamente "anticongeladas" com salmoura ( solução concentrada de sal na água), o que evita a ligação entre o gelo da neve e a superfície da estrada. Este procedimento evita o uso pesado de sal após a nevasca. Para descongelar, são usadas misturas de salmoura e sal, às vezes com agentes adicionais, como cloreto de cálcio e/ou cloreto de magnésio . O uso de sal ou salmoura torna-se ineficaz abaixo de -10 °C (14 °F).
O sal para descongelamento no Reino Unido vem predominantemente de uma única mina em Winsford em Cheshire . Antes da distribuição, é misturado com <100 ppm de ferrocianeto de sódio como agente antiaglomerante, o que permite que o sal-gema flua livremente para fora dos veículos de granulação, apesar de ser armazenado antes do uso. Nos últimos anos, esse aditivo também foi usado no sal de mesa. Outros aditivos foram usados no sal de estrada para reduzir os custos totais. Por exemplo, nos EUA, uma solução de carboidrato de subproduto do processamento de beterraba foi misturada com sal-gema e aderiu às superfícies das estradas cerca de 40% melhor do que o sal-gema solto sozinho. Por permanecer mais tempo na estrada, o tratamento não precisou ser repetido várias vezes, economizando tempo e dinheiro.
Em termos técnicos de físico-química, o ponto mínimo de congelamento de uma mistura de água e sal é −21,12 °C (−6,02 °F) para 23,31% em peso de sal. O congelamento próximo a essa concentração é tão lento que o ponto eutético de -22,4 °C (-8,3 °F) pode ser alcançado com cerca de 25% em peso de sal.
Efeitos ambientais
O sal da estrada acaba em corpos de água doce e pode prejudicar plantas e animais aquáticos, interrompendo sua capacidade de osmorregulação . A onipresença do sal representa um problema em qualquer aplicação de revestimento costeiro, pois os sais aprisionados causam grandes problemas de adesão. Autoridades navais e construtores navais monitoram as concentrações de sal nas superfícies durante a construção. As concentrações máximas de sal nas superfícies dependem da autoridade e aplicação. O regulamento IMO é mais usado e define os níveis de sal para um máximo de 50 mg/m 2 de sais solúveis medidos como cloreto de sódio. Essas medidas são feitas por meio de um teste de Bresle . A salinização (aumento da salinidade, também conhecida como síndrome de salinização da água doce ) e o subsequente aumento da lixiviação de metais é um problema contínuo em toda a América do Norte e nos cursos de água doce europeus.
No degelo de rodovias, o sal tem sido associado à corrosão de tabuleiros de pontes, veículos motorizados, barras e arames de reforço e estruturas de aço desprotegidas usadas na construção de estradas. O escoamento superficial , a pulverização de veículos e as ações do vento também afetam o solo, a vegetação à beira da estrada e o abastecimento local de águas superficiais e subterrâneas. Embora evidências de carga ambiental de sal tenham sido encontradas durante o pico de uso, as chuvas de primavera e o degelo geralmente diluem as concentrações de sódio na área onde o sal foi aplicado. Um estudo de 2009 descobriu que aproximadamente 70% do sal de estrada aplicado na área metropolitana de Minneapolis-St Paul é retido na bacia hidrográfica local.
Substituição
Algumas agências estão substituindo a cerveja , o melaço e o suco de beterraba pelo sal da estrada . As companhias aéreas utilizam mais glicol e açúcar do que soluções à base de sal para descongelamento .
Indústria alimentar e agricultura
Muitos microorganismos não podem viver em um ambiente salgado: a água é extraída de suas células por osmose . Por esse motivo, o sal é usado para conservar alguns alimentos, como bacon, peixe ou repolho.
O sal é adicionado aos alimentos, seja pelo produtor de alimentos ou pelo consumidor, como intensificador de sabor, conservante, aglutinante, aditivo de controle de fermentação , agente de controle de textura e revelador de cor. O consumo de sal na indústria alimentícia é subdividido, em ordem decrescente de consumo, em outros produtos alimentícios, frigoríficos, conservas , panificação, laticínios e moagem de grãos. O sal é adicionado para promover o desenvolvimento da cor no bacon, presunto e outros produtos de carne processada. Como conservante, o sal inibe o crescimento de bactérias. O sal atua como um aglutinante em salsichas para formar um gel de ligação feito de carne, gordura e umidade. O sal também atua como intensificador de sabor e amaciador .
Em muitas indústrias de laticínios, o sal é adicionado ao queijo como um agente de controle de cor, fermentação e textura. O subsetor de lácteos inclui empresas que fabricam manteiga cremosa, leite condensado e evaporado, sobremesas congeladas, sorvetes, queijos naturais e processados e produtos lácteos especiais. Nas conservas, o sal é adicionado principalmente como intensificador de sabor e conservante . Também é usado como veículo para outros ingredientes, agente desidratante, inibidor de enzimas e amaciante. Na panificação, o sal é adicionado para controlar a taxa de fermentação na massa do pão. Também é usado para fortalecer o glúten (o complexo elástico de proteína-água em certas massas) e como intensificador de sabor, como cobertura em produtos de panificação. A categoria de processamento de alimentos também contém produtos de moagem de grãos. Esses produtos consistem na moagem de farinha e arroz e na fabricação de cereais matinais e farinhas misturadas ou preparadas. O sal também é usado como agente de tempero, por exemplo, em batatas fritas, pretzels , comida de gato e cachorro.
O cloreto de sódio é usado na medicina veterinária como agente causador de êmese . É dado como solução saturada quente. A emese também pode ser causada pela colocação faríngea de uma pequena quantidade de sal puro ou cristais de sal.
Medicamento
O cloreto de sódio é usado junto com a água como uma das principais soluções para terapia intravenosa . O spray nasal geralmente contém uma solução salina .
combate a incêndios
O cloreto de sódio é o principal agente extintor em extintores de incêndio (Met-LX, Super D) usado em incêndios de metais combustíveis, como magnésio, potássio, sódio e ligas NaK (Classe D). Pó termoplástico é adicionado à mistura, juntamente com materiais impermeabilizantes (estearatos metálicos) e antiaglomerantes (fosfato tricálcico) para formar o agente extintor. Quando aplicado ao fogo, o sal age como um dissipador de calor, dissipando o calor do fogo, e também forma uma crosta que exclui o oxigênio para abafar o fogo. O aditivo plástico derrete e ajuda a crosta a manter sua integridade até que o metal em chamas esfrie abaixo de sua temperatura de ignição. Este tipo de extintor foi inventado no final da década de 1940 como uma unidade operada por cartucho, embora as versões de pressão armazenada sejam agora populares. Os tamanhos comuns são 30 libras (14 kg) portáteis e 350 libras (160 kg) com rodas.
Limpador
Desde pelo menos os tempos medievais , as pessoas usam sal como agente de limpeza esfregado nas superfícies domésticas. Também é usado em muitas marcas de xampu , creme dental e popularmente para descongelar calçadas e manchas de gelo.
Uso óptico
Os cristais de NaCl sem defeitos têm uma transmitância óptica de cerca de 90% para luz infravermelha, especificamente entre 200 nm e 20 µm . Eles foram, portanto, usados em componentes ópticos (janelas e prismas) operando naquela faixa espectral, onde existem poucas alternativas não absorventes e onde os requisitos de ausência de inomogeneidades microscópicas são menos rigorosos do que na faixa visível. Embora baratos, os cristais de NaCl são macios e higroscópicos - quando expostos ao ar ambiente, eles gradualmente se cobrem com "gelo". Isso limita a aplicação de NaCl a ambientes secos, áreas de montagem seladas a vácuo ou para usos de curto prazo, como prototipagem. Atualmente, materiais como o seleneto de zinco (ZnSe), que são mecanicamente mais fortes e menos sensíveis à umidade, são usados no lugar do NaCl para a faixa espectral do infravermelho.
Química
Cloreto de sódio sólido
No cloreto de sódio sólido, cada íon é cercado por seis íons de carga oposta, conforme esperado em bases eletrostáticas. Os íons circundantes estão localizados nos vértices de um octaedro regular . Na linguagem do empacotamento compacto , os íons de cloreto maiores (tamanho de 167 pm) são arranjados em uma matriz cúbica, enquanto os íons de sódio menores (116 pm) preenchem todas as lacunas cúbicas (vazios octaédricos) entre eles. Essa mesma estrutura básica é encontrada em muitos outros compostos e é comumente conhecida como halita ou estrutura cristalina do sal-gema. Ela pode ser representada como uma rede cúbica de face centrada (FCC) com uma base de dois átomos ou como duas redes cúbicas de face centrada interpenetrantes. O primeiro átomo está localizado em cada ponto da rede, e o segundo átomo está localizado a meio caminho entre os pontos da rede ao longo da borda da célula unitária FCC.
O cloreto de sódio sólido tem um ponto de fusão de 801 °C. A condutividade térmica do cloreto de sódio em função da temperatura tem um máximo de 2,03 W/(cm K) a 8 K (-265,15 °C; -445,27 °F) e diminui para 0,069 a 314 K (41 °C; 106 °F). ). Também diminui com o doping .
Imagens de vídeo em tempo real com resolução atômica permitem a visualização do estágio inicial da nucleação do cristal de cloreto de sódio.
Soluções aquosas
| Solubilidade de NaCl (g NaCl / 1 kg de solvente a 25 °C (77 °F)) |
|
|---|---|
| Água | 360 |
| Formamida | 94 |
| Glicerina | 83 |
| Propileno glicol | 71 |
| Ácido fórmico | 52 |
| amônia líquida | 30.2 |
| Metanol | 14 |
| Etanol | 0,65 |
| Dimetilformamida | 0,4 |
| Propan-1-ol | 0,124 |
| Sulfolano | 0,05 |
| Butan-1-ol | 0,05 |
| Propan-2-ol | 0,03 |
| Pentan-1-ol | 0,018 |
| Acetonitrila | 0,003 |
| Acetona | 0,00042 |
A atração entre os íons Na + e Cl − no sólido é tão forte que apenas solventes altamente polares como a água dissolvem bem o NaCl.
Quando dissolvido em água, a estrutura do cloreto de sódio se desintegra à medida que os íons Na + e Cl − ficam rodeados por moléculas polares de água. Essas soluções consistem em aquocomplexos metálicos de fórmula [Na(H 2 O) 8 ] + , com distância Na–O de 250 pm . Os íons cloreto também são fortemente solvatados, cada um sendo cercado por uma média de seis moléculas de água. As soluções de cloreto de sódio têm propriedades muito diferentes da água pura. O ponto eutético é −21,12 °C (−6,02 °F) para 23,31% de fração em massa de sal, e o ponto de ebulição da solução saturada de sal é próximo a 108,7 °C (227,7 °F). A partir de soluções frias, o sal cristaliza como NaCl·2H 2 O di- hidratado .
pH de soluções de cloreto de sódio
O pH de uma solução de cloreto de sódio permanece ≈7 devido à basicidade extremamente fraca do íon Cl − , que é a base conjugada do ácido forte HCl. Em outras palavras, o NaCl não tem efeito sobre o pH do sistema em soluções diluídas onde os efeitos da força iônica e dos coeficientes de atividade são desprezíveis.
Variantes estequiométricas e de estrutura
O sal comum tem uma proporção molar de 1:1 de sódio e cloro. Em 2013, foram descobertos compostos de sódio e cloreto de diferentes estequiometrias ; cinco novos compostos foram previstos (por exemplo, Na 3 Cl, Na 2 Cl, Na 3 Cl 2 , NaCl 3 e NaCl 7 ). A existência de alguns deles foi confirmada experimentalmente em altas pressões e outras condições: NaCl 3 cúbico e ortorrômbico, Na 3 Cl tetragonal metálico bidimensional e NaCl hexagonal exótico. Isso indica que compostos que violam a intuição química são possíveis, em sistemas simples sob condições não ambientais.
Ocorrência
A maior parte do sal do mundo é dissolvida no oceano . Uma quantidade menor é encontrada na crosta terrestre como o mineral halita solúvel em água (sal-gema), e uma pequena quantidade existe como partículas suspensas de sal marinho na atmosfera. Essas partículas são os núcleos de condensação de nuvens dominantes no mar, que permitem a formação de nuvens em ar não poluído .
Produção
Atualmente, o sal é produzido em massa pela evaporação da água do mar ou salmoura de poços de salmoura e lagos salgados . A mineração de sal-gema também é uma fonte importante. A China é o principal fornecedor mundial de sal. Em 2017, a produção mundial foi estimada em 280 milhões de toneladas , sendo os cinco maiores produtores (em milhões de toneladas) China (68,0), Estados Unidos (43,0), Índia (26,0), Alemanha (13,0) e Canadá (13,0). O sal também é um subproduto da mineração de potássio .
Mina de sal-gema moderna perto de Mount Morris , Nova York , Estados Unidos
Lagoas de evaporação de sal jordaniano e israelense no extremo sul do Mar Morto .
Montes de sal, Salar de Uyuni , Bolívia .
Veja também
- Biosalinidade
- Sal comestível (sal de mesa)
- Halite , a forma mineral de cloreto de sódio
- Efeitos do sal na saúde
- Salinidade
- Salgando a terra
- Envenenamento por sal
Referências
-
 Este artigo incorpora material de domínio público do Salt (PDF) . Serviço Geológico dos Estados Unidos .
Este artigo incorpora material de domínio público do Salt (PDF) . Serviço Geológico dos Estados Unidos .
Fontes citadas
- Haynes, William M., ed. (2011). CRC Manual de Química e Física (92ª ed.). CRC Pressione . ISBN 978-1439855119.
links externos
- Estatísticas e informações do levantamento geológico dos Estados Unidos do sal
- "Usando sal e areia para manutenção de estradas no inverno" . Jornal de Gestão Rodoviária . Dezembro de 1997. Arquivado do original em 21 de setembro de 2016 . Consultado em 13 de fevereiro de 2007 .
- Calculadoras: tensões superficiais e densidades, molaridades e molalidades de NaCl aquoso (e outros sais)
- JtBaker MSDS


![{\displaystyle {\ce {2 NaCl + 2 H2O ->[eletrólise] Cl2 + H2 + 2 NaOH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6175336b0ecf3b2032d6a60ac2a534b10e6f61f3)