Monofluorofosfato de sódio - Sodium monofluorophosphate
|
|
| Nomes | |
|---|---|
|
Nome IUPAC
Fosforofluoridato dissódico
|
|
| Outros nomes
Fluorofosfato de sódio, monofluorofosfato dissódico
|
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| ECHA InfoCard |
100.030.381 |
| Número EC | |
|
PubChem CID
|
|
| Número RTECS | |
| UNII | |
|
Painel CompTox ( EPA )
|
|
|
|
|
|
| Propriedades | |
| Na 2 PFO 3 | |
| Massa molar | 143,95 g / mol |
| Aparência | pó branco |
| Ponto de fusão | 625 ° C (1.157 ° F; 898 K) |
| 25 g / 100 mL | |
| Solubilidade | insolúvel em etanol , éter |
| Farmacologia | |
| A01AA02 ( OMS ) A12CD02 ( OMS ) | |
| Perigos | |
| Ficha de dados de segurança | Sigma-Aldrich |
| NFPA 704 (diamante de fogo) | |
| Ponto de inflamação | Não inflamável |
| Dose ou concentração letal (LD, LC): | |
|
LD 50 ( dose mediana )
|
502 mg / kg (rato, oral) |
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Referências da Infobox | |
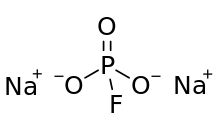
Monofluorofosfato de sódio , comumente abreviado SMFP , é um composto inorgânico com a fórmula química Na 2 PO 3 F. Típico para um sal , MFP é inodoro, incolor e solúvel em água. Este sal é um ingrediente de alguns cremes dentais .
Usos
O MFP é mais conhecido como ingrediente em alguns cremes dentais . Ele funciona como uma fonte de flúor por meio da seguinte reação de hidrólise :
- PO 3 F 2− + OH - → HPO 4 2− + F -
O flúor protege o esmalte dos dentes do ataque de bactérias que causam cáries (cáries). Embora desenvolvido por um químico da Procter and Gamble , seu uso em creme dental (creme dental Colgate e Ultra Brite ) foi patenteado pela Colgate-Palmolive , uma vez que a Procter and Gamble estava envolvida na comercialização de creme dental Crest (contendo fluoreto estanoso , comercializado como "Fluoristão" ) No início dos anos 1980, o Crest foi reformulado para usar MFP, sob a marca "Fluoristat"; hoje, os cremes dentais Crest usam fluoreto de sódio ou fluoreto estanoso . Comparado aos fluoretos puros, o monofluorofosfato de sódio tem um gosto residual ligeiramente menor.
O MFP também é usado em alguns medicamentos para o tratamento da osteoporose .
Em 1991, Calgon descobriu que o monofluorofosfato de sódio inibia a dissolução do chumbo na água potável quando usado em concentrações entre 0,1 mg / L e 500 mg / L.
Cárie dentária
A cárie dentária é causada por bactérias naturalmente presentes na boca. Essas bactérias formam uma película pegajosa e incolor nos dentes, chamada placa . Quando alimentos que contêm carboidratos ( amidos e açúcares ) são ingeridos, as bactérias que formam a placa usam o açúcar como forma de energia. Eles também o transformam em uma substância semelhante a uma cola que os ajuda a aderir à superfície do dente. A placa produz ácido , que ataca o esmalte .
Química da decadência
O esmalte dentário consiste principalmente de hidroxifosfato de cálcio, Ca 5 (PO 4 ) 3 OH, também conhecido como o mineral hidroxiapatita . A apatita é um composto duro e insolúvel. O ácido (H + ), produzido especialmente após uma refeição rica em açúcar, ataca a apatita:
- Ca 5 (PO 4 ) 3 OH (s) + H + (aq) → Ca 5 (PO 4 ) 3 + (aq) + H 2 O (ℓ)
Química da fluoretação do esmalte
A degradação da apatita pela perda de OH - faz com que o esmalte se dissolva. O processo é reversível à medida que a saliva retorna OH - para reformar a apatita. Se flúor, íons F - , estiverem presentes na saliva, fluorapatita , Ca 5 (PO 4 ) 3 F, também se forma.
- Ca 5 (PO 4 ) 3 + (aq) + F - (aq) → Ca 5 (PO 4 ) 3 F (s)
A fluorapatita resiste aos ataques de ácidos melhor do que a própria apatita, então o esmalte do dente resiste melhor à cárie do que o esmalte sem flúor.
Preparação e estrutura
O monofluorofosfato de sódio é produzido industrialmente pela reação do fluoreto de sódio com o metafosfato de sódio :
- NaPO 3 + NaF → Na 2 PO 3 F
O processo envolve a cisão de uma ligação pirofosfato, análoga à hidrólise. NaMFP também pode ser preparado tratando pirofosfato tetrassódico ou fosfato dissódico com fluoreto de hidrogênio.
No laboratório, o MFP pode ser preparado por hidrólise de íons difluorofosfato com hidróxido de sódio diluído :
- PO 2 F 2 - + 2 NaOH → Na 2 PO 3 F + H 2 O + F -
Estrutura
A estrutura do ânion fluorofosfato consiste em fósforo no centro de um tetraedro definido por três átomos de oxigênio e um flúor . As representações formais descrevem uma ligação dupla entre um átomo de oxigênio e o fósforo, com ligações simples para os outros dois átomos de oxigênio e o flúor. Nesta representação muito formal, a carga negativa está localizada nos átomos de O das ligações PO simples. MFP é semelhante e isoeletrônico com Na 2 SO 4 . O ânion tem simetria C 3v .
Descoberta e desenvolvimento
O monofluorofosfato de sódio foi descrito pela primeira vez em 1929 pelo químico alemão Willy Lange , então na Universidade de Berlim. Suas tentativas infrutíferas de preparar o ácido monofluorofosfórico livre o levaram a verificar a estabilidade de seus ésteres. Junto com Gerda von Krüger , uma de suas alunas, Lange sintetizou assim o dietil fluorofosfato e alguns análogos, que se mostraram bastante tóxicos, por serem relacionados a agentes nervosos . Na década de 1930, Gerhard Schrader , trabalhando para a empresa alemã IG Farben , tentou desenvolver inseticida sintético . Seu trabalho se concentrou em ésteres de ácido fosfórico e resultou na descoberta acidental de alguns outros agentes nervosos, como DFP ( diisopropil fluorofosfato ), Tabun , Soman e Sarin . Nesse ínterim, Lange, que era casado com uma judia, emigrou da Alemanha para os Estados Unidos e começou a trabalhar para a Procter and Gamble Company. Em 1947, ele e Ralph Livingston da Monsanto Company publicaram a preparação dos ácidos fluorofosfóricos livres e mencionaram o uso de alguns ésteres tóxicos do ácido monofluorofosfórico (como DFP) no tratamento de glaucoma e miastenia gravis . A conhecida toxicidade desses ésteres levou a temores de que os sais simples também pudessem ser tóxicos, e tais temores impediram qualquer uso comercial em larga escala dos sais. Em 1950, sob o patrocínio do fabricante dos compostos, Ozark Chemical Company , a toxicidade do monofluorofosfato de sódio foi estudada por Harold Hodge na Universidade de Rochester, que incluiu o teste anticárie. Em 1967, a Colgate-Palmolive entrou com várias patentes sobre o uso de monofluorofosfato de sódio em pasta de dente.
Segurança
O conteúdo usual de MFP em pasta de dente é de 0,76%. O composto é usado no lugar do fluoreto de sódio, principalmente em cremes dentais infantis, porque é menos tóxico, embora ambos tenham toxicidade modesta. O LD 50 em ratos é de 0,9 g / kg.
Referências
- ^ a b c d e Klaus Schrödter, Gerhard Bettermann, Thomas Staffel, Friedrich Wahl, Thomas Klein, Thomas Hofmann "Phosphoric Acid and Phosphates" em Ullmann's Encyclopedia of Industrial Chemistry 2008, Wiley-VCH, Weinheim. doi : 10.1002 / 14356007.a19_465.pub3
- ^ Wolfgang Weinert "Oral Hygiene Products" em Ullmann's Encyclopedia of Industrial Chemistry 2000, Wiley-VCH, Weinheim. doi : 10.1002 / 14356007.a18_209
- ^ a b História do monofluorofosfato de Peter Meiers
- ^ "HealthyTeeth - Dicas, notícias e análises de produtos para um sono saudável" . HealthyTeeth . Página visitada em 19 de abril de 2018 .
- ^ Davis, RE, Ph.D., Metcalfe, HC, Williams, JE, Castka, JF (1999). Química moderna . Austin, TX: Harcourt Brace & Company.
- ^ "Cópia arquivada" . Arquivado do original em 11/01/2009 . Página visitada em 06-07-2009 . CS1 maint: cópia arquivada como título ( link )

