Processo Solvay - Solvay process
O processo Solvay ou processo de amônia-soda é o principal processo industrial para a produção de carbonato de sódio (carbonato de sódio, Na 2 CO 3 ). O processo de amônia-soda foi desenvolvido em sua forma moderna pelo químico belga Ernest Solvay durante a década de 1860. Os ingredientes para isso estão prontamente disponíveis e são baratos: salmoura (de fontes no interior ou do mar) e calcário (de pedreiras). A produção mundial de carbonato de sódio em 2005 foi estimada em 42 milhões de toneladas, o que representa mais de seis quilos (13 libras) por ano para cada pessoa na Terra. As fábricas de produtos químicos da Solvay agora produzem cerca de três quartos desse suprimento, com o restante sendo extraído de depósitos naturais. Este método substituiu o processo de Leblanc .
História
O nome "carbonato de sódio" baseia-se no principal método histórico de obtenção do álcali, que consistia na utilização de água para extraí-lo das cinzas de certas plantas. A queima de madeira produziu potássio e seu ingrediente predominante carbonato de potássio (K 2 CO 3 ), enquanto as cinzas dessas plantas especiais produziram "carbonato de sódio" e seu ingrediente predominante carbonato de sódio (Na 2 CO 3 ). A palavra "refrigerante" (do latim médio) originalmente se referia a certas plantas que crescem em solúveis de sal; descobriu-se que as cinzas dessas plantas produziam o útil carbonato de sódio alcalino. O cultivo dessas plantas atingiu um estado de desenvolvimento particularmente alto no século 18 na Espanha, onde as plantas são chamadas de barrilha ; a palavra inglesa é " barilla ". As cinzas das algas também produzem carbonato de sódio e foram a base de uma enorme indústria do século 18 na Escócia. O álcali também foi extraído de leitos de lagos secos no Egito.
No final do século 18, essas fontes eram insuficientes para atender à crescente demanda da Europa por álcalis para as indústrias de sabão, têxteis e vidro. Em 1791, o médico francês Nicolas Leblanc desenvolveu um método para fabricar carbonato de sódio usando sal, calcário , ácido sulfúrico e carvão . Embora o processo de Leblanc tenha dominado a produção de álcalis no início do século 19, o gasto de seus insumos e subprodutos poluentes (incluindo gás cloreto de hidrogênio ) tornou aparente que estava longe de ser uma solução ideal.
Foi relatado que em 1811 o físico francês Augustin Jean Fresnel descobriu que o bicarbonato de sódio precipita quando o dióxido de carbono é borbulhado através de salmouras contendo amônia - que é a reação química central do processo Solvay. A descoberta não foi publicada. Como foi observado por Desmond Reilly, "A história da evolução do processo de amônio-soda é um exemplo interessante da maneira como uma descoberta pode ser feita e depois deixada de lado e não aplicada por um tempo considerável depois." A consideração séria desta reação como a base de um processo industrial data da patente britânica emitida em 1834 para HG Dyar e J. Hemming. Houve várias tentativas de reduzir essa reação à prática industrial, com sucesso variável.
Em 1861, o químico industrial belga Ernest Solvay voltou sua atenção para o problema; ele aparentemente não tinha conhecimento do extenso trabalho anterior. Sua solução, uma torre de absorção de gás de 24 metros (79 pés) na qual o dióxido de carbono borbulhava através de um fluxo descendente de salmoura. Isso, junto com a recuperação e reciclagem eficientes da amônia, mostrou-se eficaz. Em 1864, Solvay e seu irmão Alfred adquiriram apoio financeiro e construíram uma fábrica em Couillet , hoje um subúrbio da cidade belga de Charleroi . O novo processo se mostrou mais econômico e menos poluente do que o método de Leblanc, e seu uso se espalhou. Em 1874, os Solvay expandiram suas instalações com uma nova e maior fábrica em Nancy , França.
No mesmo ano, Ludwig Mond visitou a Solvay na Bélgica e adquiriu os direitos de uso da nova tecnologia. Ele e John Brunner formaram a firma Brunner, Mond & Co. , e construíram uma fábrica da Solvay em Winnington , perto de Northwich , Cheshire , Inglaterra. A instalação começou a operar em 1874. Mond foi fundamental para tornar o processo Solvay um sucesso comercial. Ele fez vários refinamentos entre 1873 e 1880 que removeram subprodutos que poderiam retardar ou interromper o processo.
Em 1884, os irmãos Solvay licenciaram os americanos William B. Cogswell e Rowland Hazard para produzir carbonato de sódio nos Estados Unidos e formaram uma joint venture ( Solvay Process Company ) para construir e operar uma fábrica em Solvay, Nova York .

Na década de 1890, as fábricas de processamento da Solvay produziam a maior parte do carbonato de sódio do mundo.
Em 1938, grandes depósitos do mineral trona foram descobertos perto do Rio Green em Wyoming, dos quais o carbonato de sódio pode ser extraído de forma mais barata do que o produzido pelo processo. Com o fechamento da fábrica original da Solvay, em Nova York, em 1986, não havia fábricas baseadas na Solvay operando na América do Norte . Em todo o resto do mundo, o processo Solvay continua sendo a principal fonte de carbonato de sódio.
Química
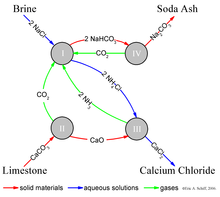
O processo Solvay resulta em carbonato de sódio (predominantemente carbonato de sódio (Na 2 CO 3 )) da salmoura (como uma fonte de cloreto de sódio (NaCl)) e do calcário (como uma fonte de carbonato de cálcio (CaCO 3 )). O processo geral é:
A implementação real dessa reação global global é intrincada. Uma descrição simplificada pode ser dada usando as quatro diferentes reações químicas interagentes ilustradas na figura. Na primeira etapa do processo, o dióxido de carbono (CO 2 ) passa por uma solução aquosa concentrada de cloreto de sódio (sal de cozinha, NaCl) e amônia (NH 3 ).
- ---(EU)
Na prática industrial, a reação é realizada passando salmoura concentrada (água salgada) através de duas torres. No primeiro, a amônia sobe pela salmoura e é absorvida por ela. No segundo, o dióxido de carbono borbulha através da salmoura amoniacal e o bicarbonato de sódio (bicarbonato de sódio) precipita da solução. Observe que, em uma solução básica , o NaHCO 3 é menos solúvel em água do que o cloreto de sódio. A amônia (NH 3 ) tampona a solução em um pH básico (alto) ; sem a amônia, um subproduto de ácido clorídrico tornaria a solução ácida e interromperia a precipitação. Aqui, o NH 4 junto com a salmoura amoniacal atua como um "licor mãe".
O "catalisador" de amônia necessário para a reação (I) é recuperado em uma etapa posterior, e relativamente pouca amônia é consumida. O dióxido de carbono necessário para a reação (I) é produzido pelo aquecimento (" calcinação ") do calcário a 950-1100 ° C e pela calcinação do bicarbonato de sódio (ver abaixo). O carbonato de cálcio (CaCO 3 ) no calcário é parcialmente convertido em cal viva (óxido de cálcio (CaO)) e dióxido de carbono:
- --- (II)
O bicarbonato de sódio (NaHCO 3 ) que precipita na reação (I) é filtrado da solução de cloreto de amônio quente (NH 4 Cl), e a solução é então reagida com a cal viva (óxido de cálcio (CaO)) remanescente do aquecimento o calcário na etapa (II).
- --- (III)
CaO é uma solução básica forte. A amônia da reação (III) é reciclada de volta para a solução de salmoura inicial da reação (I).
O bicarbonato de sódio (NaHCO 3 ) precipitado da reação (I) é então convertido no produto final, carbonato de sódio (soda de lavagem: Na 2 CO 3 ), por calcinação (160-230 ° C), produzindo água e dióxido de carbono como subprodutos :
- ---(4)
O dióxido de carbono da etapa (IV) é recuperado para reutilização na etapa (I). Quando devidamente projetada e operada, uma planta da Solvay pode recuperar quase toda a sua amônia e consome apenas pequenas quantidades de amônia adicional para compensar as perdas. Os únicos principais insumos do processo Solvay são sal, calcário e energia térmica , e seu único subproduto principal é o cloreto de cálcio , que às vezes é vendido como sal rodoviário .
No processo Solvay modificado desenvolvido pelo químico chinês Hou Debang em 1930, as primeiras etapas são as mesmas do processo Solvay. No entanto, o CaCl 2 é suplantado pelo cloreto de amônio (NH 4 Cl). Em vez de tratar a solução restante com cal, dióxido de carbono e amônia são bombeados para a solução, então cloreto de sódio é adicionado até que a solução sature a 40 ° C. Em seguida, a solução é resfriada a 10 ° C. O cloreto de amônio precipita e é removido por filtração, e a solução é reciclada para produzir mais carbonato de sódio. O processo de Hou elimina a produção de cloreto de cálcio. O subproduto cloreto de amônio pode ser refinado, utilizado como fertilizante e pode ter maior valor comercial que o CaCl 2 , reduzindo assim a extensão de leitos de dejetos.
Detalhes adicionais da implementação industrial deste processo estão disponíveis no relatório preparado para a European Soda Ash Producer's Association.
Subprodutos e resíduos
O principal subproduto do processo Solvay é o cloreto de cálcio (CaCl 2 ) em solução aquosa. O processo também contém outros resíduos e subprodutos. Nem todo o calcário calcinado é convertido em cal viva e dióxido de carbono (na reação II); o carbonato de cálcio residual e outros componentes do calcário tornam-se resíduos. Além disso, a salmoura usada pelo processo é geralmente purificada para remover íons de magnésio e cálcio, normalmente para formar carbonatos; caso contrário, essas impurezas levariam a incrustações nos vários vasos de reação e torres. Esses carbonatos são produtos residuais adicionais.
Em plantas do interior, como a de Solvay, Nova York , os subprodutos foram depositados em "leitos de lixo"; o peso do material depositado nesses leitos de resíduos excedeu o do carbonato de sódio produzido em cerca de 50%. Esses leitos de resíduos têm levado à poluição da água, principalmente por cálcio e cloreto. Os leitos de resíduos em Solvay, Nova York, aumentaram substancialmente a salinidade nas proximidades do Lago Onondaga , que costumava ser um dos lagos mais poluídos dos Estados Unidos e é um local de poluição de superfund . À medida que tais leitos de resíduos envelhecem, eles começam a apoiar comunidades de plantas que têm sido objeto de vários estudos científicos.
Em locais à beira-mar, como aqueles em Saurashtra , Gujarat, Índia, a solução CaCl 2 pode ser descarregada diretamente no mar, aparentemente sem danos ambientais substanciais, a principal preocupação é o local de descarga cair dentro do Parque Nacional Marinho do Golfo de Kutch, que serve como habitat para recifes de coral, ervas marinhas e comunidade de algas marinhas. Em Osborne, Austrália do Sul , um tanque de sedimentação é agora usado para remover 99% do CaCl 2, pois a descarga anterior estava assoreando o canal de transporte. Na Rosignano Solvay na Toscana, Itália, os resíduos de calcário produzidos pela fábrica da Solvay mudaram a paisagem, produzindo o "Spiagge Bianche" ("Praias Brancas"). Um relatório publicado em 1999 pelo Programa das Nações Unidas para o Meio Ambiente (PNUMA), listou Spiagge Bianche entre os focos de poluição prioritários nas áreas costeiras do Mar Mediterrâneo.
Sequestro de carbono e o processo Solvay
Variações no processo Solvay foram propostas para o sequestro de carbono . Uma ideia é fazer reagir o dióxido de carbono, produzido talvez pela combustão do carvão, para formar carbonatos sólidos (como o bicarbonato de sódio) que poderiam ser armazenados permanentemente, evitando assim a emissão de dióxido de carbono na atmosfera. O processo Solvay pode ser modificado para dar a reação geral:
- 2 NaCl + CaCO 3 + CO
2+ H
2O → 2NaHCO 3 + CaCl 2
Variações no processo Solvay foram propostas para converter as emissões de dióxido de carbono em carbonatos de sódio, mas o sequestro de carbono por carbonatos de cálcio ou magnésio parece mais promissor. No entanto, a quantidade de dióxido de carbono exaurido pela humanidade em comparação com a quantidade que pode ser usada para sequestro de carbono com cálcio ou magnésio é muito baixa. Além disso, a variação no processo Solvay provavelmente adicionará uma etapa adicional de energia, o que aumentará as emissões de dióxido de carbono.
Veja também
Referências
Leitura adicional
- Moffat, Wicky; Walmsley, MRW (2006). "Compreendendo a cinética de calcinação do cal para redução do custo de energia" . Associação Técnica da Indústria de Celulose e Papel da África do Sul. A energia mínima necessária para calcinar o calcário é de cerca de 3,16 gigajoules (3,00 milhões de unidades térmicas britânicas) por tonelada.