Ouriço sônico - Sonic hedgehog
Sonic hedgehog é uma proteína codificada pelo gene SHH. Esta molécula sinalizadora é a chave na regulação da morfogênese embrionária em todos os diferentes tipos de animais. SHH controla a organogênese e a organização do sistema nervoso central, membros, dedos e muitas outras partes do corpo. Sonic hedgehog é um morfogênio que padroniza o embrião em desenvolvimento usando um gradiente de concentração caracterizado pelo modelo French Flag . Este modelo tem uma distribuição não uniforme de moléculas SHH que governam diferentes destinos celulares de acordo com a concentração. Mutações neste gene podem causar holoprosencefalia , uma falha de divisão nos hemisférios cerebrais, conforme demonstrado em um experimento usando camundongos SHH knock-out em que a linha média do prosencéfalo não se desenvolveu e, em vez disso, resultou apenas uma única vesícula telencefálica fundida. O hedgehog sônico ainda desempenha um papel na diferenciação, proliferação e manutenção dos tecidos adultos. A ativação anormal da sinalização de SHH em tecidos adultos tem sido implicada em vários tipos de câncer, incluindo mama, pele, cérebro, fígado, vesícula biliar e muitos mais.
Descoberta e nomenclatura
O gene hedgehog ( hh ) foi identificado pela primeira vez na mosca da fruta Drosophila melanogaster nas telas clássicas de Heidelberg de Christiane Nüsslein-Volhard e Eric Wieschaus , publicadas em 1980. Essas telas - que os levaram a ganhar o Prêmio Nobel em 1995, junto com o geneticista do desenvolvimento Edward B. Lewis - identificou genes que controlam o padrão de segmentação dos embriões de Drosophila . O fenótipo mutante de perda de função hh faz com que os embriões sejam cobertos com dentículos - isto é, pequenas projeções pontiagudas que lembram as pontas de um ouriço . As investigações destinadas a encontrar um equivalente hedgehog em vertebrados por Philip Ingham , Andrew P. McMahon e Clifford Tabin revelaram três genes homólogos .
Dois desses genes - ouriço do deserto e ouriço indiano - receberam nomes de espécies de ouriços, enquanto o ouriço sônico recebeu o nome de Sonic the Hedgehog , o protagonista titular da franquia de videogame de mesmo nome . O gene foi batizado como tal por Robert Riddle, que era um pós-doutorado no Laboratório Tabin , depois que sua esposa Betsy Wilder voltou para casa com uma revista de jogos contendo um anúncio para o videogame Sonic the Hedgehog . No peixe - zebra , dois dos três genes hh de vertebrados são duplicados: SHH a e SHH b (anteriormente descritos como tiggywinkle hedgehog , em homenagem à Sra. Tiggy-Winkle , personagem dos livros infantis de Beatrix Potter ) e ihha e ihhb ( anteriormente descrito como equidna ouriço , em homenagem ao tamanduá espinhoso e não ao personagem Knuckles the Echidna da franquia Sonic ).
Função
Dos homólogos hh , SHH foi encontrado para ter os papéis mais críticos no desenvolvimento, agindo como um morfogênio envolvido na padronização de muitos sistemas - incluindo a hipófise anterior , pálio do cérebro, medula espinhal , pulmões , dentes e o tálamo pela zona limitans intrathalamica . Em vertebrados, o desenvolvimento de membros e dedos depende da secreção de hedgehog sônico pela zona de atividade polarizadora , localizada na face posterior do botão do membro embrionário . Mutações no gene SHH do hedgehog sônico humano causam holoprosencefalia tipo 3 HPE3, como resultado da perda da linha média ventral . A via de transcrição do hedgehog sônico também tem sido associada à formação de tipos específicos de tumores cancerígenos, incluindo o tumor cerebelar embrionário e meduloblastoma , bem como a progressão de tumores de câncer de próstata . Para que o SHH seja expresso nos membros do embrião em desenvolvimento, um morfogênio denominado fatores de crescimento de fibroblastos deve ser secretado da crista ectodérmica apical .
O hedgehog sônico também demonstrou atuar como uma pista de orientação axonal . Foi demonstrado que SHH atrai axônios comissurais na linha média ventral da medula espinhal em desenvolvimento. Especificamente, o SHH atrai os axônios das células ganglionares da retina (RGC) em baixas concentrações e os repele em concentrações mais altas. Foi demonstrado que a ausência (não expressão) de SHH controla o crescimento de membros posteriores nascentes em cetáceos ( baleias e golfinhos ).
O gene SHH é um membro da família de genes hedgehog com cinco variações de alterações na sequência de DNA ou variantes de splice. SHH está localizado no cromossomo sete e inicia a produção da proteína Sonic Hedgehog. Essa proteína envia sinais de curto e longo alcance aos tecidos embrionários para regular o desenvolvimento. Se o gene SHH está mutado ou ausente, a proteína Sonic Hedgehog não pode fazer seu trabalho corretamente. O Sonic hedgehog contribui para o crescimento celular, especificação e formação celular, estruturação e organização do plano corporal. Esta proteína funciona como uma molécula de sinalização morfogênica vital e desempenha um papel importante na formação de muitas estruturas diferentes no desenvolvimento de embriões. O gene SHH afeta vários sistemas de órgãos importantes, como o sistema nervoso, o sistema cardiovascular, o sistema respiratório e o sistema musculoesquelético. Mutações no gene SHH podem causar malformação de componentes desses sistemas, o que pode resultar em grandes problemas no desenvolvimento do embrião. O cérebro e os olhos, por exemplo, podem ser significativamente afetados por mutações nesse gene e causar distúrbios como Microftalmia e Holoprosencefalia . Microftalmia é uma condição que afeta os olhos, resultando em pequenos tecidos subdesenvolvidos em um ou ambos os olhos. Isso pode levar a problemas que variam de um coloboma a um único olho pequeno e até a ausência total de olhos. Holoprosencefalia é uma condição mais comumente causada por uma mutação do gene SHH que causa a separação inadequada do cérebro direito e esquerdo e dismorfia facial. Muitos sistemas e estruturas dependem fortemente da expressão adequada do gene SHH e da subsequente proteína hedgehog sônica, ganhando a distinção de ser um gene essencial para o desenvolvimento.
Padronização do sistema nervoso central
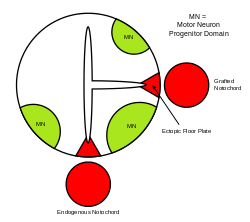
A molécula de sinalização de hedgehog sônico (SHH) assume vários papéis na padronização do sistema nervoso central (SNC) durante o desenvolvimento dos vertebrados . Uma das funções mais caracterizadas do SHH é seu papel na indução da placa do assoalho e de diversos tipos de células ventrais dentro do tubo neural . O notocórdio - uma estrutura derivada do mesoderma axial - produz SHH, que viaja extracelularmente para a região ventral do tubo neural e instrui essas células a formarem a placa do assoalho. Outra visão da indução da placa de piso pressupõe que algumas células precursoras localizadas no notocórdio são inseridas na placa neural antes de sua formação, posteriormente dando origem à placa de piso.
O próprio tubo neural é a base inicial do SNC dos vertebrados , e a placa do assoalho é uma estrutura especializada, localizada no ponto médio ventral do tubo neural. As evidências que apóiam o notocórdio como centro de sinalização vêm de estudos nos quais um segundo notocórdio é implantado próximo a um tubo neural in vivo, levando à formação de uma placa de assoalho ectópica dentro do tubo neural.
O hedgehog sônico é a proteína secretada que medeia as atividades de sinalização do notocórdio e da placa base. Estudos envolvendo a expressão ectópica de SHH in vitro e in vivo resultam na indução da placa de assoalho e na diferenciação de neurônios motores e interneurônios ventrais . Por outro lado, os camundongos mutantes para SHH não apresentam características da medula espinhal ventral. O bloqueio in vitro da sinalização de SHH usando anticorpos contra ela mostra fenótipos semelhantes. O SHH exerce seus efeitos de maneira dependente da concentração, de forma que uma alta concentração de SHH resulta em uma inibição local da proliferação celular . Essa inibição faz com que a placa de base se torne fina em comparação com as regiões laterais do tubo neural . A concentração mais baixa de SHH resulta na proliferação celular e na indução de vários tipos de células neurais ventrais. Uma vez que a placa de piso é estabelecida, as células que residem nesta região irão, subsequentemente, expressar SHH, gerando um gradiente de concentração dentro do tubo neural.
Embora não haja evidência direta de um gradiente de SHH , há evidência indireta por meio da visualização da expressão do gene Patched ( Ptc ) , que codifica para o domínio de ligação ao ligante do receptor de SHH em todo o tubo neural ventral. Estudos in vitro mostram que mudanças incrementais de duas e três vezes na concentração de SHH dão origem ao neurônio motor e a diferentes subtipos interneuronais encontrados na medula espinhal ventral. Essas mudanças incrementais in vitro correspondem à distância dos domínios do tecido de sinalização (notocórdio e placa de assoalho), que posteriormente se diferencia em diferentes subtipos neuronais à medida que ocorre in vitro . Sugere-se que a sinalização SHH graduada seja mediada pela família Gli de proteínas, que são homólogas de vertebrados do fator de transcrição Cubitus interruptus ( Ci ) contendo dedo de zinco de Drosophila . Ci é um mediador crucial da sinalização de hedgehog ( Hh ) em Drosophila . Em vertebrados, três proteínas Gli diferentes estão presentes, viz. Gli1 , Gli2 e Gli3 , que são expressos no tubo neural. Camundongos mutantes para Gli1 mostram desenvolvimento normal da medula espinhal, sugerindo que é dispensável para mediar a atividade de SHH. No entanto, os camundongos mutantes Gli2 mostram anormalidades na medula espinhal ventral, com defeitos graves na placa do assoalho e interneurônios mais ventrais (V3). Gli3 antagoniza a função SHH de uma maneira dependente da dose , promovendo subtipos neuronais dorsais. Os fenótipos mutantes SHH podem ser resgatados em um mutante duplo SHH / Gli3 . As proteínas Gli têm um domínio de ativação C-terminal e um domínio repressivo N.
SHH é sugerido para promover a função de ativação de Gli2 e inibir a atividade repressiva de Gli3. SHH também parece promover a função de ativação de Gli3, mas essa atividade não é forte o suficiente. A concentração graduada de SHH dá origem à atividade graduada de Gli 2 e Gli3, que promovem os subtipos neuronais ventral e dorsal na medula espinhal ventral. Evidências de mutantes Gli3 e SHH / Gli3 mostram que SHH regula principalmente a restrição espacial de domínios progenitores em vez de ser indutivo, pois mutantes SHH / Gli3 mostram mistura de tipos de células.
O SHH também induz outras proteínas com as quais interage, e essas interações podem influenciar a sensibilidade de uma célula ao SHH. A proteína que interage com o ouriço ( HHIP ) é induzida por SHH, que por sua vez atenua sua atividade de sinalização. A vitronectina é outra proteína induzida por SHH; ele atua como um cofator obrigatório para a sinalização de SHH no tubo neural.
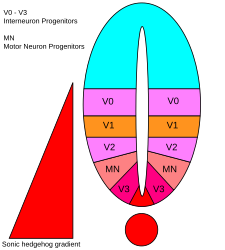
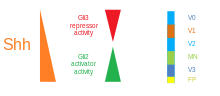
Existem cinco domínios progenitores distintos no tubo neural ventral: interneurônios V3 , neurônios motores (MN), interneurônios V2 , V1 e V0 (na ordem ventral para dorsal). Esses diferentes domínios progenitores são estabelecidos por "comunicação" entre diferentes classes de fatores de transcrição homeobox . (Consulte o nervo trigêmeo .) Esses fatores de transcrição respondem à concentração do gradiente de SHH. Dependendo da natureza de sua interação com SHH, eles são classificados em dois grupos - classe I e classe II - e são compostos por membros das famílias Pax , Nkx , Dbx e Irx . As proteínas de classe I são reprimidas em diferentes limiares de SHH delineando os limites ventrais dos domínios progenitores , enquanto as proteínas de classe II são ativadas em diferentes limiares de SHH delineando o limite dorsal dos domínios. As interações repressivas cruzadas seletivas entre as proteínas da classe I e da classe II dão origem a cinco subtipos neuronais ventrais cardinais.
É importante observar que o SHH não é a única molécula sinalizadora que exerce um efeito no tubo neural em desenvolvimento. Muitas outras moléculas, vias e mecanismos estão ativos (por exemplo, RA , FGF , BMP ), e interações complexas entre SHH e outras moléculas são possíveis. BMPs são sugeridos para desempenhar um papel crítico na determinação da sensibilidade da célula neural à sinalização de SHH. As evidências que apóiam isso vêm de estudos usando inibidores de BMP que ventralizam o destino da célula da placa neural para uma determinada concentração de SHH. Por outro lado, a mutação em antagonistas de BMP (por exemplo, noggin ) produz defeitos graves nas características mais ventrais da medula espinhal, seguidos por expressão ectópica de BMP no tubo neural ventral. As interações de SHH com Fgf e RA ainda não foram estudadas em detalhes moleculares.
Atividade morfogenética
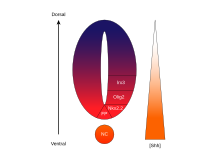
A atividade de SHH, dependente da concentração e do tempo, que determina o destino da célula no tubo neural ventral , torna-o um excelente exemplo de um morfogênio . Em vertebrados, a sinalização SHH na porção ventral do tubo neural é mais notavelmente responsável pela indução de células da placa do assoalho e neurônios motores . SHH emana da notocorda e placa do assoalho ventral do tubo neural em desenvolvimento para criar um gradiente de concentração que abrange o eixo dorsoventral e é antagonizado por um gradiente inverso de Wnt , que especifica a medula espinhal dorsal. Concentrações mais altas do ligante SHH são encontradas nos aspectos mais ventrais do tubo neural e notocórdio, enquanto concentrações mais baixas são encontradas nas regiões mais dorsais do tubo neural. O gradiente de concentração de SHH foi visualizado no tubo neural de camundongos projetados para expressar uma proteína de fusão SHH :: GFP para mostrar esta distribuição graduada de SHH durante o tempo de padronização do tubo neural ventral.
Acredita-se que o gradiente de SHH funcione para eliciar vários destinos celulares diferentes por um mecanismo dependente da concentração e do tempo que induz uma variedade de fatores de transcrição nas células progenitoras ventrais . Cada um dos domínios progenitores ventrais expressa uma combinação altamente individualizada de fatores de transcrição - Nkx2.2, Olig2, Nkx6.1, Nkx6.2, Dbx1, Dbx2, Irx3, Pax6 e Pax7 - que é regulada pelo gradiente SHH. Esses fatores de transcrição são induzidos sequencialmente ao longo do gradiente de concentração de SHH em relação à quantidade e ao tempo de exposição ao ligante de SHH. À medida que cada população de células progenitoras responde aos diferentes níveis da proteína SHH, elas começam a expressar uma combinação única de fatores de transcrição que leva à diferenciação do destino das células neuronais. Esta expressão de gene diferencial induzida por SHH cria limites nítidos entre os domínios discretos da expressão do fator de transcrição, que, em última análise, padroniza o tubo neural ventral.
O aspecto espacial e temporal da indução progressiva de genes e destinos de células no tubo neural ventral é ilustrado pelos domínios de expressão de dois dos fatores de transcrição mais bem caracterizados, Olig2 e Nkx2.2. No início do desenvolvimento, as células na linha média ventral foram expostas a uma baixa concentração de SHH por um período de tempo relativamente curto e expressam o fator de transcrição Olig2. A expressão de Olig2 se expande rapidamente em uma direção dorsal concomitantemente com a extensão dorsal contínua do gradiente de SHH ao longo do tempo. No entanto, conforme a frente morfogenética do ligante SHH se move e começa a crescer mais concentrada, as células que são expostas a níveis mais elevados do ligante respondem desligando Olig2 e ligando Nkx2.2, criando uma fronteira nítida entre as células que expressam o fator de transcrição Nkx2.2 ventral às células que expressam Olig2. É dessa forma que cada um dos domínios das seis populações de células progenitoras é pensado para ser sucessivamente padronizado em todo o tubo neural pelo gradiente de concentração de SHH. A inibição mútua entre pares de fatores de transcrição expressos em domínios vizinhos contribui para o desenvolvimento de fronteiras nítidas; no entanto, em alguns casos, a relação inibitória foi encontrada mesmo entre pares de fatores de transcrição de domínios mais distantes. Particularmente, NKX2-2 expresso no domínio V3 é relatado para inibir IRX3 expresso em V2 e mais domínios dorsais, embora V3 e V2 sejam separados por um outro domínio denominado MN.
A expressão de SHH na zona ectodérmica frontonasal (FEZ), que é um centro de sinalização responsável pelo desenvolvimento padronizado da mandíbula superior, regula o desenvolvimento craniofacial mediando pela família miR-199 na FEZ. Especificamente, os sinais dependentes de SHH do cérebro regulam genes da família miR-199 com regulação negativa dos genes miR-199 aumentando a expressão de SHH e resultando em faces mais largas, enquanto as regulações superiores dos genes miR-199 diminuem a expressão de SHH resultando em faces estreitas.
Desenvolvimento de dente
Sonic hedgehog (SHH) é uma molécula sinalizadora que é codificada pelo mesmo gene Sonic hedgehog. SHH desempenha um papel muito importante na organogênese e, mais importante, no desenvolvimento craniofacial. Por ser o SHH uma molécula sinalizadora, ele atua principalmente por difusão ao longo de um gradiente de concentração, afetando as células de diferentes maneiras. No desenvolvimento inicial do dente, o SHH é liberado do nó primário do esmalte - um centro de sinalização - para fornecer informações posicionais em um padrão de sinalização lateral e plano no desenvolvimento do dente e na regulação do crescimento da cúspide dentária. O SHH, em particular, é necessário para o crescimento de alças cervicais epiteliais, onde os epitélios externo e interno se unem e formam um reservatório para células-tronco dentárias. Depois que os nós primários do esmalte são apoptados, os nós secundários são formados. Os nós secundários do esmalte secretam SHH em combinação com outras moléculas de sinalização para engrossar o ectoderma oral e começar a padronizar as formas complexas da coroa de um dente durante a diferenciação e mineralização. Em um modelo de gene knockout, a ausência de SHH é indicativa de holoprosencefalia . No entanto, o SHH ativa moléculas a jusante de Gli2 e Gli3. Embriões mutantes Gli2 e Gli3 têm desenvolvimento anormal de incisivos que são interrompidos no desenvolvimento inicial dos dentes, bem como pequenos molares.
Desenvolvimento pulmonar
Embora o SHH seja mais comumente associado ao desenvolvimento de dedos no cérebro e nos membros, também é importante no desenvolvimento do pulmão. Estudos usando qPCR e nocautes demonstraram que o SHH contribui para o desenvolvimento pulmonar embrionário. A ramificação do pulmão dos mamíferos ocorre no epitélio dos brônquios e pulmões em desenvolvimento . SHH expresso em todo o endoderma do intestino anterior (mais interno das três camadas germinativas) no epitélio distal, onde os pulmões embrionários estão se desenvolvendo. Isso sugere que o SHH é parcialmente responsável pela ramificação dos pulmões. Outras evidências do papel de SHH na ramificação do pulmão foram vistas com qPCR. A expressão de SHH ocorre nos pulmões em desenvolvimento por volta do dia 11 embrionário e é fortemente expressa nos botões dos pulmões fetais, mas baixa nos brônquios em desenvolvimento. Camundongos com deficiência de SHH podem desenvolver fístula traqueoesofágica (conexão anormal do esôfago e da traqueia). Além disso, um modelo de camundongo nocaute duplo (SHH - / -) exibiu desenvolvimento pulmonar pobre. Os pulmões do duplo nocaute SHH não passaram por lobação e ramificação (ou seja, os pulmões anormais desenvolveram apenas um ramo, em comparação com um fenótipo extensamente ramificado do tipo selvagem).
Função regenerativa potencial
O hedgehog sônico pode desempenhar um papel na regeneração de células ciliadas de mamíferos . Ao modular a atividade da proteína retinoblastoma na cóclea de rato, o hedgehog sônico permite que as células ciliadas maduras que normalmente não podem retornar a um estado proliferativo se dividam e se diferenciem. As proteínas de retinoblastoma suprimem o crescimento celular, impedindo que as células retornem ao ciclo celular , evitando assim a proliferação. A inibição da atividade do Rb parece permitir que as células se dividam. Portanto, o hedgehog sônico - identificado como um importante regulador de Rb - também pode ser uma característica importante no crescimento das células ciliadas após o dano.
O SHH é importante para regular a adipogênese dérmica pelas células amplificadoras do trânsito do folículo piloso (HF-TACs). Especificamente, o SHH induz a angiogênese dérmica agindo diretamente nos precursores de adipócitos e promovendo sua proliferação por meio da expressão do gene do receptor γ ativado por proliferador de peroxissoma (Pparg).
Em processamento
SHH passa por uma série de etapas de processamento antes de ser secretado pela célula. SHH recentemente sintetizado pesa 45 kDa e é referido como a pré- proteína . Como uma proteína secretada, ela contém uma curta sequência de sinal em seu terminal N, que é reconhecida pela partícula de reconhecimento de sinal durante a translocação para o retículo endoplasmático (RE), a primeira etapa da secreção da proteína . Uma vez que a translocação está completa, a sequência de sinal é removida pela peptidase de sinal no ER. Lá, SHH é submetido a autoprocessamento para gerar um domínio de sinalização N-terminal de 20 kDa (SHH-N) e um domínio de terminal C de 25 kDa sem nenhum papel de sinalização conhecido. A clivagem é catalisada por uma protease dentro do domínio C-terminal. Durante a reação, uma molécula de colesterol é adicionada ao terminal C de SHH-N. Assim, o domínio C-terminal atua como uma inteína e uma transferase de colesterol. Outra porção hidrofóbica , um palmitato , é adicionada à alfa-amina da cisteína N-terminal de SHH-N. Esta modificação é necessária para uma sinalização eficiente, resultando em um aumento de 30 vezes na potência em relação à forma não palmitilada e é realizada por um membro da família O-aciltransferase ligada à membrana Proteína-cisteína N-palmitoiltransferase HHAT .
Robotnikinin
Um potencial inibidor da via de sinalização Hedgehog foi encontrado e apelidado de "Robotnikinin" - em homenagem ao inimigo de Sonic, o Hedgehog, Dr. Ivo "Eggman" Robotnik .
Antiga controvérsia em torno do nome
O gene foi associado a uma condição conhecida como holoprosencefalia , que pode resultar em graves defeitos cerebrais, cranianos e faciais, fazendo com que alguns médicos e cientistas critiquem o nome, alegando que soa muito frívolo. Foi notado que a menção de uma mutação em um gene hedgehog sônico pode não ser bem recebida em uma discussão sobre um distúrbio sério com um paciente ou sua família. Essa controvérsia em grande parte morreu, e o nome agora é geralmente visto como uma relíquia humorística da época anterior ao surgimento do sequenciamento completo do genoma rápido e barato e da nomenclatura padronizada. O problema da "inadequação" dos nomes de genes como "Mothers against decapentaplegia" , "Lunatic fringe" e "Sonic hedgehog" é amplamente evitado usando abreviações padronizadas ao falar com os pacientes e suas famílias.
Galeria
Veja também
- Pikachurin , uma proteína retinal nomeada em homenagem a Pikachu
- Zbtb7 , um oncogene originalmente chamado de " Pokémon "
Referências
Leitura adicional
- Dorus S, Anderson JR, Vallender EJ, Gilbert SL, Zhang L, Chemnick LG, Ryder OA, Li W, Lahn BT (2006). "Sonic Hedgehog, um gene de desenvolvimento chave, experimentou uma evolução molecular intensificada em primatas" . Human Molecular Genetics . 15 (13): 2031–7. doi : 10.1093 / hmg / ddl123 . PMID 16687440 .
- Gilbert, Scott F. (2000). Biologia do desenvolvimento (6ª ed.). Sunderland, Mass: Sinauer Associates. ISBN 978-0-87893-243-6.
- Kim J, Kim P, Hui CC (2001). "A associação VACTERL: lições da via do Sonic hedgehog". Genética clínica . 59 (5): 306–15. doi : 10.1034 / j.1399-0004.2001.590503.x . PMID 11359461 . S2CID 34304310 .
- Morton JP, Lewis BC (2007). "Sinalização de SHH e câncer de pâncreas: implicações para a terapia?" . Ciclo celular . 6 (13): 1553–7. doi : 10.4161 / cc.6.13.4467 . PMID 17611415 . S2CID 4670615 .
- Mullor JL, Sánchez P, Ruiz i Altaba A (2003). "Caminhos e consequências: Hedgehog signaling in human disease". Trends Cell Biol . 12 (12): 562–9. doi : 10.1016 / S0962-8924 (02) 02405-4 . PMID 12495844 .
- Nanni L, Ming JE, Du Y, Hall RK, Aldred M, Bankier A, Muenke M (2001). "A mutação SHH está associada ao incisivo central superior mediano solitário: um estudo de 13 pacientes e revisão da literatura". American Journal of Medical Genetics . 102 (1): 1–10. doi : 10.1002 / 1096-8628 (20010722) 102: 1 <1 :: AID-AJMG1336> 3.0.CO; 2-U . PMID 11471164 .
- Williams JA (2006). "Ouriço e lesão medular". Opinião de especialista sobre metas terapêuticas . 9 (6): 1137–45. doi : 10.1517 / 14728222.9.6.1137 . PMID 16300466 . S2CID 5548531 .
links externos
- Um artigo introdutório sobre SHH no Davidson College
- Redescobrindo a biologia: Unidade 7 Genética do desenvolvimento .. Entrevista com transcrições de entrevistas com especialistas John Incardona PhD .. explicação da descoberta e nomenclatura do gene hedgehog sônico
- 'Sonic Hedgehog' soou engraçado no início .. New York Times 12 de novembro de 2006 ..
- Entrada GeneReviews / NCBI / NIH / UW na Visão geral de Anoftalmia / Microftalmia
- SHH - Sonic hedgehog US National Library of Medicine
- Visão geral de todas as informações estruturais disponíveis no PDB para UniProt : Q15465 (proteína hedgehog humana Sonic) no PDBe-KB .
- Visão geral de todas as informações estruturais disponíveis no PDB para UniProt : Q62226 (proteína hedgehog de rato Sonic) no PDBe-KB .