Estados de spin (elétrons d) - Spin states (d electrons)
Os estados de spin ao descrever complexos de coordenação de metais de transição referem-se às configurações potenciais de spin dos elétrons d do metal central. Em muitos, esses estados de spin variam entre configurações de spin alto e baixo . Essas configurações podem ser compreendidas por meio dos dois modelos principais usados para descrever complexos de coordenação; teoria do campo do cristal e teoria do campo do ligante , que é uma versão mais avançada baseada na teoria dos orbitais moleculares .
Giro alto vs. giro baixo
Complexos octaédricos
A divisão Δ dos orbitais d desempenha um papel importante no estado de spin do elétron de um complexo de coordenação. Três fatores afetam Δ: o período (linha na tabela periódica) do íon metálico, a carga do íon metálico e a intensidade do campo dos ligantes do complexo, conforme descrito pela série espectroquímica . Apenas complexos octaédricos de metais de transição de primeira linha adotam estados de alto spin.
Para que ocorra a divisão de spin baixo, o custo de energia de colocar um elétron em um orbital já ocupado individualmente deve ser menor do que o custo de colocar o elétron adicional em um orbital eg a um custo de energia de Δ. Se a energia necessária para emparelhar dois elétrons for maior do que o custo de energia para colocar um elétron em um e g , Δ, ocorre uma divisão de spin alto.
Se a separação entre os orbitais for grande, então os orbitais de baixa energia são completamente preenchidos antes da população dos orbitais superiores de acordo com o princípio de Aufbau . Complexos como esse são chamados de "spin baixo", pois o preenchimento de um orbital combina os elétrons e reduz o spin total do elétron. Se a separação entre os orbitais for pequena o suficiente, então é mais fácil colocar elétrons nos orbitais de energia mais alta do que colocar dois no mesmo orbital de baixa energia, por causa da repulsão resultante da combinação de dois elétrons no mesmo orbital. Portanto, um elétron é colocado em cada um dos cinco orbitais d antes que qualquer emparelhamento ocorra de acordo com a regra de Hund, resultando no que é conhecido como complexo de "spin alto". Complexos como esse são chamados de "spin alto", pois povoar o orbital superior evita combinações entre elétrons com spin oposto.
A carga do centro metálico desempenha um papel no campo do ligante e na divisão Δ. Quanto mais alto o estado de oxidação do metal, mais forte é o campo de ligante criado. No caso de haver dois metais com a mesma configuração de elétron d, aquele com o estado de oxidação mais alto tem maior probabilidade de ter spin baixo do que aquele com o estado de oxidação mais baixo. Por exemplo, Fe 2+ e Co 3+ são ambos d 6 ; no entanto, a carga mais alta de Co 3+ cria um campo de ligante mais forte do que Fe 2+ . Todas as outras coisas sendo iguais, Fe 2+ tem mais probabilidade de ter spin alto do que Co 3+ .
Os ligantes também afetam a magnitude da divisão Δ dos orbitais d de acordo com sua intensidade de campo, conforme descrito pela série espectroquímica . Ligantes de campo forte, como CN - e CO, aumentam a divisão Δ e são mais propensos a serem de spin baixo. Ligantes de campo fraco, como I - e Br - causam uma divisão Δ menor e são mais propensos a ter spin alto.
Alguns complexos octaédricos exibem cruzamento de spin , onde os estados de spin alto e baixo existem é equilíbrio dinâmico.
Complexos tetraédricos
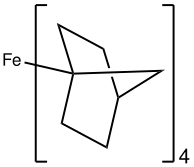
A energia de divisão Δ para complexos de metal tetraédrico (quatro ligantes), Δ tet é menor do que para um complexo octaédrico. Consequentemente, os complexos tetraédricos são quase sempre de spin alto. Exemplos de complexos tetraédricos de baixo spin incluem Fe (2-norbornil) 4 , [Co (4-norbornil) 4 ] + , e o complexo nitrosil Cr (NO) ( (N (tms) 2 ) 3 .
Complexos planos quadrados
Muitos complexos d 8 dos metais da primeira linha existem em geometria tetraédrica ou quadrada plana. Em alguns casos, essas geometrias existem em equilíbrios mensuráveis. Por exemplo, o diclorobis (trifenilfosfina) níquel (II) foi cristalizado nas geometrias tetraédrica e plana quadrada.
Teoria do campo de ligante vs teoria do campo de cristal
Em termos de divisão orbial d, a teoria do campo do ligante (LFT) e a teoria do campo cristalino (CFT) fornecem resultados semelhantes. CFT é um modelo mais antigo e simples que trata ligantes como cargas pontuais. LFT é mais químico, enfatiza a ligação covalente e acomoda a ligação pi explicitamente.
Sistemas de alta rotação e baixa rotação
No caso de complexos octaédricos, a questão do spin alto vs spin baixo surge primeiro para d 4 , uma vez que ele tem mais do que 3 elétrons para preencher os orbitais d não ligados de acordo com a teoria do campo do ligante ou os orbitais d estabilizados de acordo com o cristal divisão de campo.
Todos os complexos de metais de segunda e terceira linha são de baixo spin.
- d 4
- Alta rotação octaédrica: 4 elétrons desemparelhados, paramagnéticos , substitucionalmente lábeis. Inclui Cr 2+ . Muitos complexos designados como Cr (II) são, no entanto, Cr (III) com ligantes reduzidos ), Mn 3+ .
- Low spin octaédrico: 2 elétrons desemparelhados, paramagnéticos , substitucionalmente inertes. Inclui Cr 2+ , Mn 3+ .
- d 5
- Alta rotação octaédrica: 5 elétrons desemparelhados, paramagnéticos , substitucionalmente lábeis. Inclui Fe 3+ , Mn 2+ . Exemplo: Tris (acetilacetonato) ferro (III) .
- Low spin octaédrico: 1 elétron desemparelhado, paramagnético , substitucionalmente inerte. Inclui Fe 3+ . Exemplo: [Fe (CN) 6 ] 3− .
- d 6
- Alta rotação octaédrica: 4 elétrons desemparelhados, paramagnéticos , substitucionalmente lábeis. Inclui Fe 2+ , Co 3+ . Exemplos: [Fe (H 2 O) 6 ] 2+ , [CoF 6 ] 3− .
- Low spin octaédrico: sem elétrons desemparelhados, diamagnético , substitucionalmente inerte. Inclui Fe 2+ , Ni 4+ . Exemplo: [Co (NH 3 ) 6 ] 3+ .
- d 7
- Alta rotação octaédrica: 3 elétrons desemparelhados, paramagnéticos , substitucionalmente lábeis. Inclui Co 2+ , Ni 3+ .
- Low spin octaédrico: 1 elétron desemparelhado, paramagnético , substitucionalmente lábil. Inclui Co 2+ , Ni 3+ . Exemplo: [Co (NH 3 ) 6 ] 2+ .
- d 8
- Alta rotação octaédrica: 2 elétrons desemparelhados, paramagnéticos , substitucionalmente lábeis. Inclui Ni 2+ . Exemplo: [Ni (NH 3 ) 6 ] 2+ .
- Alta rotação tetraédrica: 2 elétrons desemparelhados, paramagnéticos , substitucionalmente lábeis. Inclui Ni 2+ . Exemplo: [NiCl 4 ] 2- .
- Low spin planar quadrado: sem elétrons desemparelhados, diamagnético , substitucionalmente inerte. Inclui Ni 2+ . Exemplo: [Ni (CN) 4 ] 2− .
Raios iônicos
O estado de spin do complexo afeta o raio iônico de um átomo . Para uma determinada contagem de elétrons d, os complexos de spin alto são maiores.
d 4
- Alta rotação octaédrica: Cr 2+ , 64,5 pm .
- Baixa rotação octaédrica: Mn 3+ , 58 pm.
- d 5
- Alta rotação octaédrica: Fe 3+ , o raio iônico é 64,5 pm.
- Baixo spin octaédrico: Fe 3+ , o raio iônico é 55 pm.
- d 6
- Alta rotação octaédrica: Fe 2+ , o raio iônico é 78 pm, raio iônico Co 3+ 61 pm.
- Baixa rotação octaédrica: Inclui raio iônico Fe 2+ 62 pm, raio iônico Co 3+ 54,5 pm, raio iônico Ni 4+ 48 pm.
- d 7
- Alta rotação octaédrica: raio iônico Co 2+ 74,5 pm, raio iônico Ni 3+ 60 p.
- Baixa rotação octaédrica: raio iônico Co 2+ 65 pm, raio iônico Ni 3+ 56 pm.
- d 8
- Alta rotação octaédrica: Ni 2+ raio iônico 69 pm.
- Low spin planar quadrado: Ni 2+ raio iônico 49 pm.
Taxas de câmbio do ligando
Geralmente, as taxas de dissociação do ligante de complexos de spin baixo são menores do que as taxas de dissociação de complexos de spin alto. No caso de complexos octaédricos, os electrões no E g níveis são anti-aglutinante em relação às ligações de metal-ligando. Os famosos complexos de "troca inerte" são complexos octaédricos de d 3 e íons metálicos de baixo spin d 6 , ilustrados respeitosamente por Cr 3+ e Co 3+ .