Nusinersen - Nusinersen
 | |
| Dados clínicos | |
|---|---|
| Nomes comerciais | Spinraza |
| Outros nomes | IONIS-SMN Rx , ISIS-SMN Rx |
| AHFS / Drugs.com | Monografia |
| MedlinePlus | a617010 |
| Dados de licença | |
Categoria de gravidez |
|
| Vias de administração |
Intratecal |
| Código ATC | |
| Status legal | |
| Status legal | |
| Dados farmacocinéticos | |
| Biodisponibilidade | 100% (intratecal) |
| Ligação proteica | <25% (no LCR),> 94% (no plasma) |
| Metabolismo | Exonuclease (3'- e 5 ') - hidrólise mediada |
| Meia-vida de eliminação | 135-177 dias (no CSF ), 63-87 dias (no plasma ) |
| Identificadores | |
| |
| Número CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| Dados químicos e físicos | |
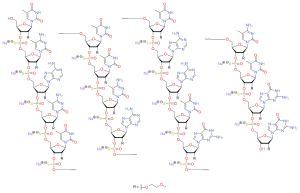
| Fórmula | C 234 H 323 N 61 Na 17 O 128 P 17 S 17 |
| Massa molar | 7 500 .86 g · mol −1 |
| |
Nusinersen , comercializado como Spinraza , é um medicamento usado no tratamento da atrofia muscular espinhal (SMA), uma doença neuromuscular rara . Em dezembro de 2016, tornou-se o primeiro medicamento aprovado usado no tratamento desse distúrbio.
Como a doença que trata é tão rara, o Nusinersen tem a designação de “ medicamento órfão ” nos Estados Unidos e na União Europeia.
Usos médicos
A droga é usada para tratar a atrofia muscular espinhal associada a uma mutação no gene SMN1 . É administrado diretamente no sistema nervoso central (SNC) por meio de injeção intratecal .
Em testes clínicos, a droga interrompeu a progressão da doença. Em cerca de 60% dos bebês afetados pela atrofia muscular espinhal tipo 1, melhora a função motora.
Efeitos colaterais
Pessoas tratadas com nusinersen tiveram um risco aumentado de infecções respiratórias superiores e inferiores e congestão, infecções de ouvido, constipação, aspiração pulmonar , dentição e escoliose . Existe o risco de o crescimento de bebês e crianças ser atrofiado . Em indivíduos mais velhos de ensaios clínicos, os eventos adversos mais comuns foram cefaleia, dor nas costas e outros efeitos adversos da injeção espinhal , como cefaleia pós-punção dural .
Embora não tenha sido observado nos pacientes do estudo, uma redução nas plaquetas , bem como um risco de lesão renal, são riscos teóricos para os medicamentos antisense e, portanto, as plaquetas e a função renal devem ser monitoradas durante o tratamento.
Em 2018, surgiram vários casos de hidrocefalia comunicante em crianças e adultos tratados com nusinersen; ainda não está claro se isso estava relacionado a drogas.
Farmacologia
A atrofia muscular espinhal é causada por mutações de perda de função no gene SMN1 que codifica a proteína do neurônio motor de sobrevivência (SMN) . As pessoas sobrevivem devido a pequenas quantidades da proteína SMN produzida a partir do gene SMN2 . Nusinersen modula o splicing alternativo do gene SMN2 , convertendo-o funcionalmente no gene SMN1 , aumentando assim o nível da proteína SMN no SNC.
A droga se distribui para o SNC e tecidos periféricos.
A meia-vida é estimada em 135 a 177 dias no líquido cefalorraquidiano (LCR) e 63 a 87 dias no plasma sanguíneo . O fármaco é metabolizado por hidrólise mediada por exonuclease (3′- e 5 ′) e não interage com as enzimas CYP450 . A principal via de eliminação é provavelmente a excreção urinária de nusinersen e seus metabólitos.
Química
Nusinersen é um oligonucleotídeo antisense no qual os grupos 2'-hidroxi dos anéis de ribofuranosil são substituídos por grupos 2'- O -2-metoxietil e as ligações fosfato são substituídas por ligações fosforotioato .
História
O Nusinersen foi desenvolvido em uma colaboração entre Adrian Krainer do Cold Spring Harbor Laboratory e a Ionis Pharmaceuticals (anteriormente chamada de Isis Pharmaceuticals). O trabalho inicial de descoberta de alvos de nusinersen foi feito pelo Dr. Ravindra Singh e colegas de trabalho da Escola de Medicina da Universidade de Massachusetts, financiado pela Cure SMA.
A partir de 2012, a Ionis fez parceria com a Biogen no desenvolvimento e, em 2015, a Biogen adquiriu uma licença exclusiva para o medicamento por uma taxa de licença de US $ 75 milhões , pagamentos por etapas de até US $ 150 milhões e royalties escalonados a partir de então; A Biogen também pagou os custos de desenvolvimento após a obtenção da licença. A licença da Biogen incluía licenças de propriedade intelectual que a Ionis havia adquirido do Cold Spring Harbor Laboratory e da University of Massachusetts.
Em novembro de 2016, a nova droga pedido foi aceite no âmbito do FDA 's revisão prioritária processo sobre a força de ensaio de Fase III e a necessidade não atendida, e também foi aceito para revisão na Agência Europeia de Medicamentos (EMA) na época. Foi aprovado pelo FDA em dezembro de 2016 e pela EMA em maio de 2017 como o primeiro medicamento para tratar SMA. Posteriormente, o nusinersen foi aprovado para tratar SMA no Canadá (julho de 2017), Japão (julho de 2017), Brasil (agosto de 2017) e Suíça (setembro de 2017).
Sociedade e cultura
Economia
O preço de tabela do Nusinersen nos EUA é de US $ 125.000 por injeção, o que coloca o custo do tratamento em US $ 750.000 no primeiro ano e US $ 375.000 anualmente depois disso. De acordo com o The New York Times , isso coloca o nusinersen "entre os medicamentos mais caros do mundo".
Em outubro de 2017, as autoridades da Dinamarca recomendaram nusinersen para uso apenas em um pequeno subconjunto de pessoas com SMA tipo 1 (bebês) e se recusaram a oferecê-lo como um tratamento padrão para todas as outras pessoas com SMA, citando um "preço excessivamente alto" em comparação para o benefício.
As autoridades norueguesas rejeitaram o financiamento em outubro de 2017 porque o preço do medicamento era "antiético alto". Em fevereiro de 2018, o financiamento foi aprovado para menores de 18 anos.
Em agosto de 2018, o Instituto Nacional de Excelência em Saúde e Cuidados (NICE), que avalia o custo-efetividade das terapias para o NHS na Inglaterra e no País de Gales, recomendou não oferecer nusinersen a pessoas com SMA. Crianças com SMA tipo 1 foram tratadas no Reino Unido sob um programa de acesso expandido financiado pela Biogen ; depois de matricular 80 crianças, o esquema fechou para novas pessoas em novembro de 2018. Em maio de 2019, no entanto, o NICE reverteu sua postura e anunciou sua decisão de recomendar o nusinersen para uso em um amplo espectro de SMA por um período de 5 anos.
O Irish Health Service Executive decidiu em fevereiro de 2019 que nusinersen era muito caro para financiar, dizendo que o custo seria de cerca de € 600.000 por paciente no primeiro ano e cerca de € 380.000 por ano depois disso "com um impacto orçamentário estimado em mais de € 20 milhões durante um período de cinco anos "para as 25 crianças com SMA que vivem na Irlanda. Tanto o fabricante quanto os grupos de pacientes contestaram os números e apontaram que os acordos de preços reais para a Irlanda estão em linha com o preço negociado para a iniciativa BeneluxA da qual a Irlanda é membro desde junho de 2018.
Em maio de 2019, o nusinersen estava disponível na saúde pública em mais de 40 países.
Referências
Leitura adicional
- Finkel RS, Chiriboga CA, Vajsar J, Day JW, Montes J, De Vivo DC, et al. (Dezembro de 2016). "Tratamento da atrofia muscular espinhal de início infantil com nusinersen: um estudo de fase 2, aberto, escalonamento de dose". Lancet . 388 (10063): 3017–3026. doi : 10.1016 / S0140-6736 (16) 31408-8 . PMID 27939059 . S2CID 40696239 .
links externos
- "Cortar e colar: Tratar a atrofia muscular espinhal com Nusinersen" . Youreka Science . Página visitada em 28/05/2019 .
- "Acesso a Spinraza por país" . TreatSMA . Página visitada em 28/05/2019 .
