Fórmula estrutural - Structural formula

A fórmula estrutural de um composto químico é uma representação gráfica da estrutura molecular (determinada por métodos de química estrutural ), mostrando como os átomos estão possivelmente dispostos no espaço tridimensional real . A ligação química dentro da molécula também é mostrada, explícita ou implicitamente. Ao contrário das fórmulas químicas , que têm um número limitado de símbolos e são capazes de apenas um poder descritivo limitado, as fórmulas estruturais fornecem uma representação geométrica mais completa da estrutura molecular. Por exemplo, muitos compostos químicos existem em diferentes formas isoméricas , que possuem diferentes estruturas enantioméricas , mas a mesma fórmula química .
Vários formatos de nomenclatura química sistemática , como em bancos de dados químicos , são usados que são equivalentes e tão poderosos quanto as estruturas geométricas. Esses sistemas de nomenclatura química incluem SMILES , InChI e CML . Esses nomes químicos sistemáticos podem ser convertidos em fórmulas estruturais e vice-versa, mas os químicos quase sempre descrevem uma reação química ou síntese usando fórmulas estruturais em vez de nomes químicos, porque as fórmulas estruturais permitem que o químico visualize as moléculas e as mudanças estruturais que ocorrem em durante as reações químicas.
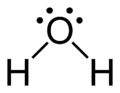
Estruturas de Lewis
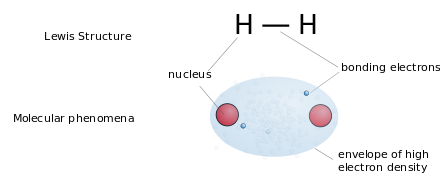
As estruturas de Lewis (ou "estruturas de pontos de Lewis") são fórmulas gráficas planas que mostram a conectividade de átomos e pares solitários ou elétrons desemparelhados , mas não a estrutura tridimensional. Essa notação é usada principalmente para moléculas pequenas. Cada linha representa os dois elétrons de uma única ligação . Duas ou três linhas paralelas entre pares de átomos representam ligações duplas ou triplas, respectivamente. Alternativamente, pares de pontos podem ser usados para representar pares de ligação. Além disso, todos os elétrons não ligados (emparelhados ou não) e quaisquer cargas formais nos átomos são indicados.
Fórmulas condensadas
Nas primeiras publicações de química orgânica, onde o uso de gráficos era fortemente limitado, surgiu um sistema tipográfico para descrever estruturas orgânicas em uma linha de texto. Embora este sistema tenda a ser problemático na aplicação a compostos cíclicos, continua a ser uma maneira conveniente de representar estruturas simples:
- CH 3 CH 2 OH ( etanol )
Os parênteses são usados para indicar vários grupos idênticos, indicando ligação ao átomo não hidrogênio mais próximo à esquerda quando aparece dentro de uma fórmula, ou ao átomo à direita quando aparece no início de uma fórmula:
- (CH 3 ) 2 CHOH ou CH (CH 3 ) 2 OH ( 2-propanol )
Em todos os casos, todos os átomos são mostrados, incluindo átomos de hidrogênio.
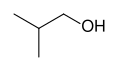
Fórmulas esqueléticas
As fórmulas esqueléticas são a notação padrão para moléculas orgânicas mais complexas. Nesse tipo de diagrama, usado pela primeira vez pelo químico orgânico Friedrich August Kekulé von Stradonitz , os átomos de carbono estão implícitos em estar localizados nos vértices (cantos) e nas extremidades dos segmentos de linha, em vez de serem indicados pelo símbolo atômico C. Átomos de hidrogênio anexados a átomos de carbono não são indicados: cada átomo de carbono é entendido como estando associado a átomos de hidrogênio suficientes para dar ao átomo de carbono quatro ligações. A presença de uma carga positiva ou negativa em um átomo de carbono toma o lugar de um dos átomos de hidrogênio implícitos. Os átomos de hidrogênio ligados a átomos que não sejam de carbono devem ser escritos explicitamente.
Fórmula esquelética de isobutanol , (CH 3 ) 2 CHCH 2 OH
Indicação de estereoquímica
Existem vários métodos para representar o arranjo tridimensional dos átomos em uma molécula ( estereoquímica ).
Estereoquímica em fórmulas esqueléticas

A quiralidade nas fórmulas esqueléticas é indicada pelo método de projeção Natta . Cunhas sólidas representam ligações apontando acima do plano do papel, enquanto cunhas tracejadas representam ligações apontando abaixo do plano.
Estereoquímica não especificada
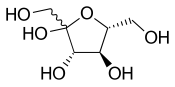
As ligações simples onduladas representam estereoquímica desconhecida ou não especificada ou uma mistura de isômeros. Por exemplo, o diagrama acima mostra a molécula de frutose com uma ligação ondulada ao grupo HOCH 2 - à esquerda. Neste caso, as duas estruturas de anel possíveis estão em equilíbrio químico entre si e também com a estrutura de cadeia aberta. O anel abre e fecha automaticamente, às vezes fechando com uma estereoquímica e às vezes com a outra.
As fórmulas esqueléticas podem representar isômeros cis e trans de alquenos. Ligações simples onduladas são a forma padrão de representar estereoquímica desconhecida ou não especificada ou uma mistura de isômeros (como com estereocentros tetraédricos). Uma dupla ligação cruzada tem sido usada algumas vezes, mas não é mais considerada um estilo aceitável para uso geral.
Desenhos de perspectiva
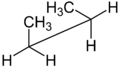
Projeção de Newman e projeção de cavalete
A projeção de Newman e a projeção do cavalete são usadas para representar conformadores específicos ou para distinguir a estereoquímica vicinal . Em ambos os casos, dois átomos de carbono específicos e sua ligação de ligação são o centro das atenções. A única diferença é uma perspectiva ligeiramente diferente: a projeção de Newman olhando diretamente para o vínculo de interesse, a projeção do cavalete olhando para o mesmo vínculo, mas de um ponto de vista um tanto oblíquo . Na projeção de Newman, um círculo é usado para representar um plano perpendicular à ligação, distinguindo os substituintes no carbono frontal dos substituintes no carbono posterior. Na projeção do cavalete, o carbono frontal está geralmente à esquerda e está sempre ligeiramente mais baixo:
Projeção de Newman de butano
Conformações de ciclohexano
Certas conformações de ciclohexano e outros compostos de anel pequeno podem ser mostradas usando uma convenção padrão. Por exemplo, a conformação de cadeira padrão de ciclohexano envolve uma vista em perspectiva ligeiramente acima do plano médio dos átomos de carbono e indica claramente quais grupos são axiais (apontando verticalmente para cima ou para baixo) e quais são equatoriais (quase horizontais, ligeiramente inclinados para cima ou para baixo ) Os títulos na frente podem ou não ser destacados com linhas ou cunhas mais fortes.
Projeção de Haworth
A projeção de Haworth é usada para açúcares cíclicos . As posições axial e equatorial não são distinguidas; em vez disso, os substituintes são posicionados diretamente acima ou abaixo do átomo do anel ao qual estão conectados. Substituintes de hidrogênio são normalmente omitidos.
Projeção fischer
A projeção de Fischer é usada principalmente para monossacarídeos lineares . Em qualquer centro de carbono, as linhas de ligação verticais são equivalentes a marcações estereoquímicas em hash, direcionadas para longe do observador, enquanto as linhas horizontais são equivalentes a cunhas, apontando para o observador. A projeção é irreal, já que um sacarídeo nunca adotaria essa conformação eclipsada . No entanto, a projeção de Fischer é uma maneira simples de representar vários estereocentros sequenciais que não requer ou implica qualquer conhecimento da conformação real:
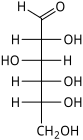
Projeção Fischer de D- Glucose
Limitações
Uma fórmula estrutural é um modelo simplificado que não pode representar certos aspectos das estruturas químicas. Por exemplo, a ligação formalizada pode não ser aplicável a sistemas dinâmicos, como ligações deslocalizadas . A aromaticidade é um desses casos e depende da convenção para representar a ligação. Diferentes estilos de fórmulas estruturais podem representar a aromaticidade de maneiras diferentes, levando a diferentes representações do mesmo composto químico. Outro exemplo são as ligações duplas formais, em que a densidade do elétron é espalhada para fora da ligação formal, levando ao caráter da ligação dupla parcial e à lenta interconversão à temperatura ambiente. Para todos os efeitos dinâmicos, a temperatura afetará as taxas de interconversão e pode alterar a forma como a estrutura deve ser representada. Não há temperatura explícita associada a uma fórmula estrutural, embora muitos presumam que seria a temperatura padrão .
Veja também
Referências
links externos
- A importância das fórmulas estruturais
- Fórmulas estruturais {link quebrado: dezembro de 2020}
- Como obter fórmulas estruturais usando cristalografia