Síntese total de estricnina - Strychnine total synthesis
A síntese total de estricnina em química descreve a síntese total da biomolécula complexa estricnina . O primeiro método relatado pelo grupo de Robert Burns Woodward em 1954 é considerado um clássico nesta área de pesquisa.
Na época, isso formou a conclusão natural de um elaborado processo de elucidação da estrutura molecular que começou com o isolamento da estricnina dos grãos de Strychnos ignatii por Pierre Joseph Pelletier e Joseph Bienaimé Caventou em 1818. Os principais contribuintes para todo o esforço foram Sir Robert Robinson com mais de 250 publicações e Hermann Leuchs com mais 125 artigos em um intervalo de tempo de 40 anos. Robinson recebeu o Prêmio Nobel de Química em 1947 por seu trabalho com alcalóides, incluindo a estricnina.
O processo de identificação química foi completado com publicações em 1946 por Robinson e mais tarde confirmado por Woodward em 1947. Estruturas de raios-X estabelecendo a configuração absoluta tornaram-se disponíveis entre 1947 e 1951 com publicações de JM Bijvoet e JH Robertson .
Woodward publicou um breve relato sobre a síntese de estricnina em 1954 (apenas 3 páginas) e um extenso (42 páginas) em 1963.
Muitos outros métodos existem e foram relatados pelos grupos de pesquisa de Magnus, Overman, Kuehne, Rawal, Bosch, Vollhardt, Mori, Shibasaki, Li, Fukuyama Vanderwal e MacMillan. A (+) - estricnina sintética também é conhecida. Sínteses racêmicas foram publicadas pela Padwa em 2007 e em 2010 pela Andrade e pela Reissig. Em sua publicação de 1963, Woodward citou Sir Robert Robinson, que disse que, por seu tamanho molecular, é a substância mais complexa conhecida .
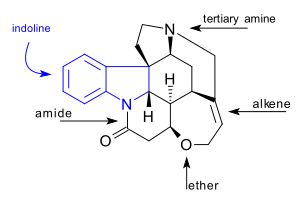
A molécula
A molécula de estricnina C 21 H 22 N 2 O 2 contém 7 anéis incluindo um sistema indolina . Possui um grupo amina terciária , uma amida , um alqueno e um grupo éter . O composto de ocorrência natural também é quiral com 6 átomos de carbono assimétricos, incluindo um quaternário.
Síntese Woodward
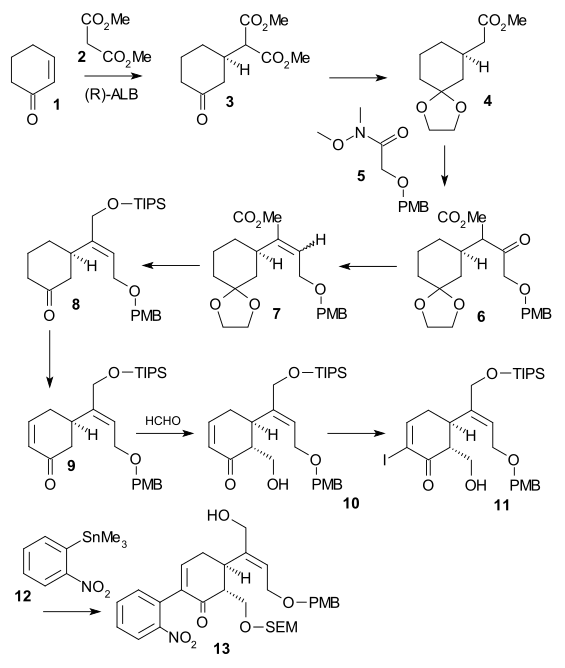
Síntese de Anel II, V
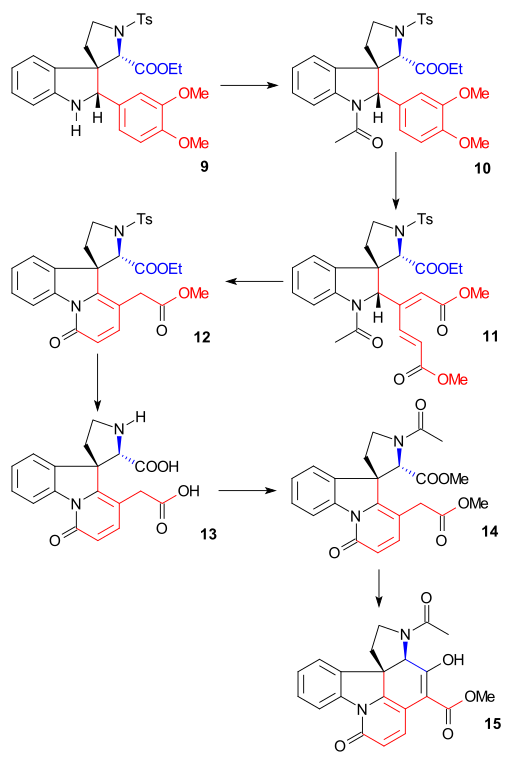
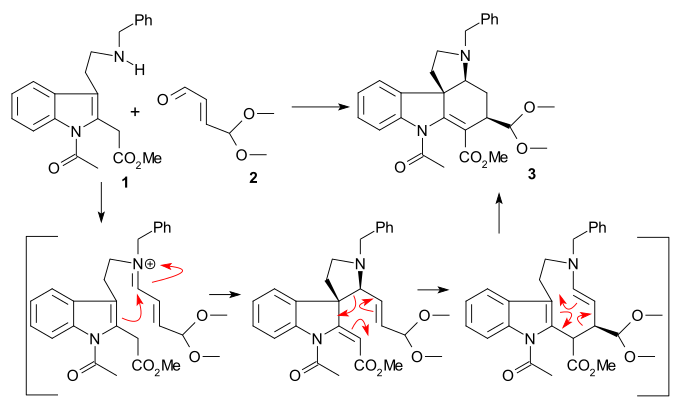
A síntese do anel II foi realizada com a síntese de indol de Fischer usando fenil-hidrazina 1 e o derivado de acetofenona acetoveratrona 2 (catalisador ácido polifosfórico ) para dar o 2-veratrilindol 3 . O grupo veratril não apenas bloqueia a posição 2 para posterior substituição eletrofílica, mas também se tornará parte do esqueleto da estricnina. Uma reação de Mannich com formaldeído e dimetilamina ) produziu gramina 4 . A alquilação com iodometano deu um sal de amônio quaternário intermediário que reagiu com cianeto de sódio em uma substituição nucleofílica para nitrila 5 e depois em uma redução com hidreto de alumínio e lítio para triptamina 6 . A condensação de amina-carbonila com glioxilato de etila dá a imina 7 . A reação desta imina com TsCl em piridina ao composto N-tosil 8 de anel fechado foi descrita por Woodward como um ataque de enamina nucleofílica e formalmente uma reação de Pictet-Spengler . Este composto deve formar-se como um par diastereomérico, mas apenas um composto foi encontrado, embora qual não tenha sido investigado. Finalmente, a ligação dupla recém-formada foi reduzida por boro-hidreto de sódio a indolina 9 com o átomo de hidrogênio C8 se aproximando do lado menos impedido (este próton é removido posteriormente na sequência e não tem importância).
Síntese de Anel III, IV
Indolina 9 foi acetilada em N-acetil composto 10 ( anidrido acético , piridina ) e então o grupo veratril foi então aberto com ozônio em ácido acético aquoso para éster mucônico 11 (possibilitado pelos dois grupos metóxido doadores de elétrons). Este é um exemplo de síntese bioinspirada já proposta por Woodward em 1948. A clivagem do grupo acetil e a hidrólise do éster com HCl em metanol resultou na formação do éster de piridona 12 com isomerização adicional da dupla ligação exocíclica a uma dupla ligação endocíclica (destruindo uma assimétrica Centro). O tratamento subsequente com iodeto de hidrogênio e fósforo vermelho removeu o grupo tosil e hidrolisou os dois grupos éster restantes para formar o diácido 13 . A acetilação e esterificação ( diazometano ) produziram acetil diéster 14 que foi então submetido a uma condensação Dieckman com metóxido de sódio em metanol para enol 15 .
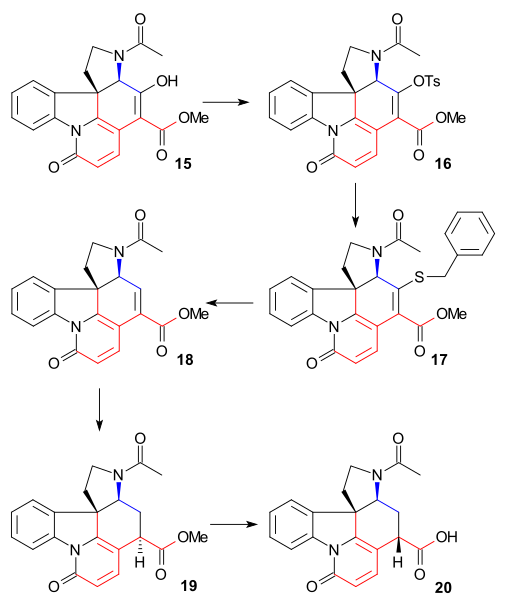
Síntese do anel VII
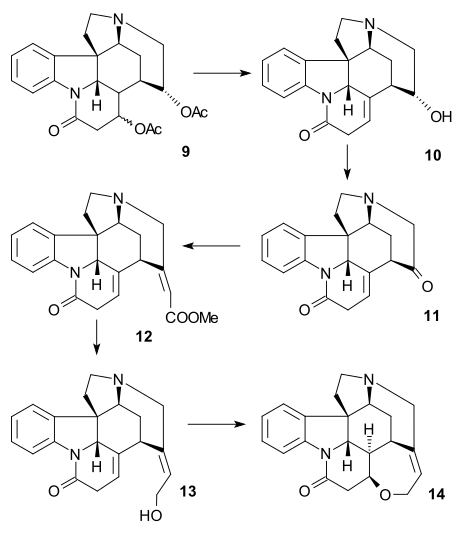
A fim de remover o grupo álcool C15 , Enol 15 foi convertido em tosilato 16 ( TsCl , piridina ) e depois em mercaptoéster 17 (benzilmercaptida de sódio) que foi então reduzido a éster insaturado 18 por níquel de Raney e hidrogênio . A redução adicional com hidrogênio / paládio sobre carbono proporcionou o éster saturado 19 . A hidrólise do éster alcalino em ácido carboxílico 20 foi acompanhada por epimerização em C14.
Este composto particular já era conhecido a partir de estudos de degradação de estricnina. Até agora, todos os intermediários eram racêmicos, mas a quiralidade foi introduzida neste estágio específico por meio da resolução quiral usando quinidina .
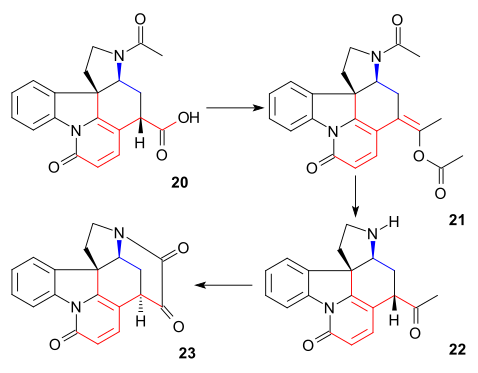
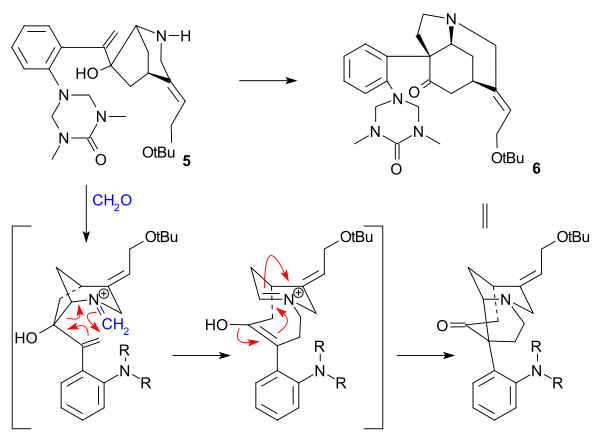
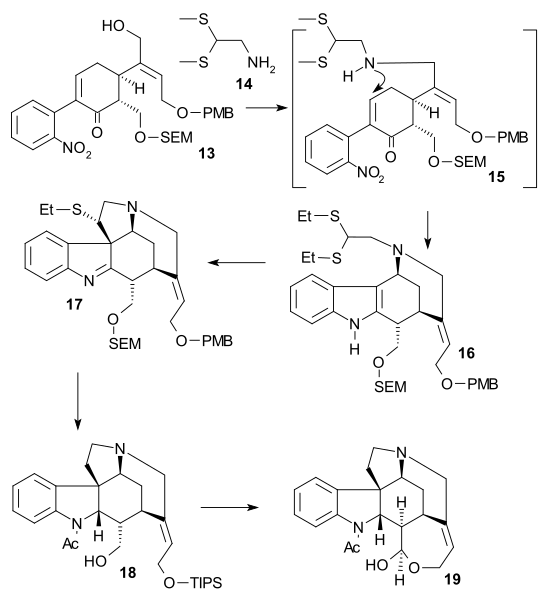
O átomo de carbono C20 foi então introduzido por anidrido acético para formar enol acetato 21 e a aminocetona livre 22 foi obtida por hidrólise com ácido clorídrico . O anel VII no intermediário 23 foi fechado por oxidação de dióxido de selênio , um processo acompanhado por epimerização novamente em C14.
A formação de 21 pode ser concebida como uma sequência de acilação, desprotonação, rearranjo com perda de dióxido de carbono e novamente acilação:
Síntese de anel VI
À dicetona 23 foi adicionado acetileto de sódio (trazendo os átomos de carbono 22 e 23) para dar o alcino 24 . Este composto foi reduzido ao álcool alílico 25 usando o catalisador de Lindlar e o hidreto de alumínio e lítio removeu o grupo cetona restante em 26 . Um rearranjo alílico para álcool 27 (isostricnina) foi provocado por brometo de hidrogênio em ácido acético seguido por hidrólise com ácido sulfúrico . Na etapa final para (-) - tratamento com estricnina 28 de 27 com hidróxido de potássio etanólico causou rearranjo da ligação dupla C12-13 e fechamento do anel em uma adição conjugada pelo ânion hidroxila.
Síntese magnus
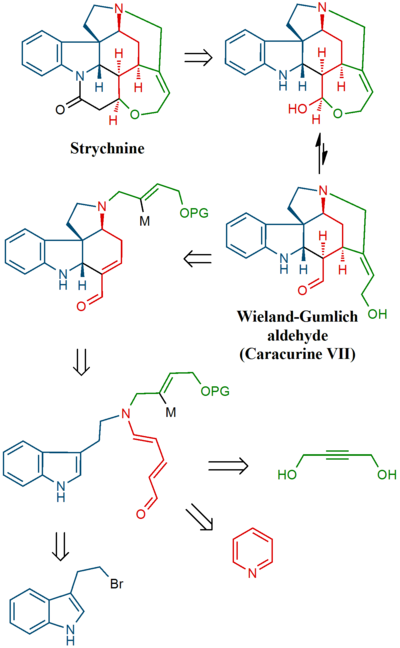
Nesse esforço, um dos muitos produtos de degradação da estricnina foi sintetizado primeiro (o composto de retransmissão), um composto também disponível em várias etapas de outro produto de degradação denominado aldeído de Wieland-Gumlich . Na etapa final, a própria estricnina foi sintetizada a partir do composto de retransmissão.
Síntese Overman
A síntese de Overman (1993) tomou um composto de ciclopenteno quiral como material de partida obtido por hidrólise enzimática de cis -1,4-diacetoxiciclopent-2-eno. Este material de partida foi convertido em várias etapas em trialquilestanano 2 que foi então acoplado com um iodeto de arila 1 em uma reação de Stille na presença de monóxido de carbono ( tris (dibenzilidenoacetona) dipaládio (0) , trifenilarsina ). O duplo interno em 3 foi convertido em um epóxido usando hidroperóxido de terc-butila , o grupo carbonila foi então convertido em um alceno em uma reação de Wittig usando Ph 3 P = CH 2 e o grupo TIPS foi hidrolisado ( TBAF ) e substituído por uma trifluoroacetamida grupo (NH 2 COCF 3 , NaH ) em 4 . A ciclização (NaH) ocorreu em seguida, abrindo o anel epóxido e o grupo trifluoroacetil foi removido usando KOH proporcionando azabiciclooctano 5 .
A etapa principal foi uma reação aza- Cope Mannich iniciada por uma condensação de amina-carbonila usando formaldeído e formando 6 em um rendimento quantitativo:
Na sequência final, a estricnina foi obtida através do aldeído Wieland-Gumlich ( 10 ):
O intermediário 6 foi acilado usando cianoformato de metila e dois grupos de proteção ( terc-butil e) foram removidos usando HCl / MeOH em 7 . A ligação dupla C8C13 foi reduzida com zinco (MeOH / H + ) para o éster saturado 8 (mistura). A epimerização em C13 com metóxido de sódio em MeOH produziu beta-éster 9 que foi reduzido com [[hidreto de diisobutilalumínio]] para aldeído Wieland-Gumlich 10 . A conversão desse composto com ácido malônico em (-) - estricnina 11 já era conhecida como procedimento.
Síntese de Kuehne
A síntese de Keuhne de 1993 diz respeito à estricnina racêmica . Os compostos de partida triptamina 1 e 4,4-dimetoxi acroleína 2 foram feitos reagir juntamente com trifluoreto de boro em acetal 3 como um único diastereômero em uma sequência de condensação amina-carbonila / rearranjo sigmatrópico .
A hidrólise com ácido perclórico proporcionou o aldeído 4 . Uma reação de Johnson-Corey-Chaykovsky ( iodeto de trimetilsulfônio / n-butil-lítio ) converteu o aldeído em um epóxido que reagiu in situ com a amina terciária em sal de amônio 5 (contaminado com outros produtos de ciclização). A redução ( paládio sobre carbono / hidrogênio ) removeu o grupo benzila para álcool 6 , mais redução ( cianoboro-hidreto de sódio ) e acilação ( anidrido acético / piridina ) produziu 7 como uma mistura de epímeros (em C17). O fechamento do anel do anel III a 8 foi então realizado com uma reação aldol usando bis (trimetilsilil) amida de lítio (usando apenas o epímero com a configuração correta). Ainda mais redução ( boro-hidreto de sódio ) e acilação resultou em di-acetato 9 epimérico .
Uma reação de eliminação mediada por DBU formou álcool olefínico 10 e subsequente oxidação de Swern tem uma amino cetona instável 11 . Nas etapas finais, uma reação de Horner-Wadsworth-Emmons ( metil 2- (diethy1fosfono) acetato ) dá éster de acrilato 12 como uma mistura de isômeros cis e trans que poderiam ser treinados na direção certa (trans) pela aplicação de luz em um fotoquímico rearranjo , o grupo éster foi reduzido ( DIBAL / trifluoreto de boro ) a isostricnina 13 e a estricnina racêmica 14 foi formada por fechamento de anel catalisado por base como na síntese de Woodward.
Na síntese de Keuhne de 1998 de (-) - estricnina quiral, o material de partida foi derivado de triptofano quiral .
Síntese Rawal
Na síntese de Rawal (1994, racêmica), a amina 1 e a enona 2 foram combinadas em uma condensação de amina-carbonila seguida por extinção de cloroformato de metila para trieno 3, que foi então reagido em uma reação de Diels-Alder (benzeno 185 ° C) para hexeno 4 . Os três grupos éster foram hidrolisados usando iodotrimetilsilano formando lactama pentacíclica 5 após uma extinção de metanol em uma combinação de 7 etapas de reação (uma delas uma condensação de Dieckmann ). O segmento C 4 6 foi adicionado em uma alquilação de amina e a reação de Heck de 7 formou a isostricnina 8 após a desprotecção de TBS.
O rendimento geral (10%) é até o momento o maior de qualquer um dos métodos publicados
Síntese de Bosch
Na síntese de Bosch de (1999, quiral), o grupo olefina na diona 1 foi convertido em um aldeído por ozonólise e a amina quiral 2 foi formada em uma aminação redutiva dupla com ( S ) -1- fenetilamina . O substituinte feniletil foi removido usando ClCO 2 CHClCH 3 e o grupo enona foi introduzido em uma eliminação Grieco usando TMSI , HMDS então PhSeCl então ozônio e então diisopropilamina formando carbamato 3 . O grupo amino foi desprotegido por refluxo em metanol e, em seguida, alquilado usando ( Z ) -BrCH 2 CICH = CH 2 OTBDMS, na amina terciária 4 . Uma reação de Heck redutiva ocorreu em seguida, seguida por metoxicarbonilação (LiHMDS, NCCO 2 Me) para o triciclo 5 . A reação com pó de zinco em ácido sulfúrico a 10% removeu o grupo protetor TBDMS , reduziu o grupo nitro e provocou uma ciclização de amino-carbonila redutora em uma única etapa para tetracíclico 6 (mistura epimérica). Na etapa final da reação do aldeído 7 de Wieland-Gumlich com NaH em MeOH proporcionou o epímero correto, foi seguida pela redução com DIBAH do éster metílico.
Síntese de Vollhardt
A principal reação na síntese de Vollhardt (2000, racêmica) foi uma trimerização alcino do derivado de triptamina 1 com acetileno e composto de organocobalto CpCo (C 2 H 4 ) 2 (THF, 0 ° C) para o triciclo 2 após a desproteção do grupo amina ( KOH, MeOH / H 2 O refluxo). A reação subsequente com nitrato de ferro trouxe uma adição de [1,8] - conjugado ao tetraciclo 3 , alquilação de amina com ( Z ) -1-bromo-4 - [(tert-butildimetilsilil) oxi] -2-iodobut-2-eno ( veja síntese Rawal) e carbonato de lítio , e isomerização do sistema dieno (NaOiPr, iPrOH) formado enona 4 . Uma reação de Heck como na síntese de Rawal ( acetato de paládio / trifenilfosfina ), acompanhada por aromatização formou piridona 5 e redução de hidreto de alumínio e lítio e desproteção do grupo TBS formou isostricnina 6 .
Síntese de Mori
A síntese de Mori ((-) quiral, 2003) foi a primeira contendo uma etapa de reação assimétrica . Ele também apresenta um grande número de reações catalisadas por Pd. Nele N-tosil amina 1 reagiu com alil carbonato 2 em uma substituição alílica assimétrica usando Pd 2 (dba) 3 e ligante assimétrico (S-BINAPO) para amina secundária quiral 3 . A dessililação do grupo TBDMS ocorreu em seguida por HCl no hidróxido e depois no nitrila 4 ( NaCN ) através do brometo ( PBr 3 ). A reação de Heck ( Pd (OAc) 2 / Me 2 PPh ) e desbrominação ( Ag 2 CO 3 ) proporcionou o triciclo 5 . A redução do nitrilo LiALH 4 na amina e sua proteção Boc 2 O na boc amina 6 foi então seguida por uma segunda oxidação alílica ( Pd (OAc) 2 / AcOH / benzoquinona / MnO 2 ) no tetraciclo 7 . A oxidação por hidroboração ( 9-BBN / H 2 O 2 ) deu álcool 8 e subsequente cetona de oxidação de Swern 9 . A reaco com LDA / PhNTf 2 deu o triflato de enol 10 e o grupo triflato foi removido no alceno 11 por reaco com Pd (OAc) 2 e PPh 3 .
A detosilação de 11 ( naftaleneto de sódio ) e a amidação com cloreto de ácido cloreto de 3-bromoacriloil deu amida 12 e outra reação de Heck deu pentaciclo 13 . isomerização de ligação dupla ( sódio / iPrOH ), desprotecção do grupo Boc ( ácido triflico ) e alquilação de amina com (Z) -BrCH 2 CICH = CH 2 OTBDMS (ver Rawal) deu o composto 14 (idêntico a um dos intermediários de Vollhardt). Uma reação de heck final ( 15 ) e a desproteção de TBDMS formou (-) - isostricnina 16 .
Síntese de Shibasaki
A síntese de Shibasaki ((-) quiral, 2002) foi um segundo método publicado na síntese total de estricnina usando uma etapa de reação assimétrica . A ciclohexenona 1 foi reagida com malonato de dimetila 2 em uma reação de Michael assimétrica usando AlLibis (binaftoxido) para formar o diéster quiral 3 . Seu grupo cetona foi protegido como um acetal (2-etil-2-metil-1,3-dioxolano, TsOH ) e um grupo carboxila foi removido ( LiCl , DMSO 140 ° C) em monoéster 4 . Um fragmento C2 foi adicionado como amida 5 de Weinreb para formar éter PMB 6 usando LDA . A cetona foi então reduzida ao álcool ( NaBH 3 CN , TiCl 4 ) e, em seguida, a água foi eliminada ( DCC , CuCl ) para formar o alceno 7 . Após a redução do éster ( DIBAL ) ao álcool e sua proteção TIPS ( TIPSOTf , trietilamina ), o grupo acetal foi removido ( CSA catalítico ) em cetona 8 . Enone 9 foi então formado por oxidação de Saegusa . A conversão em álcool 10 foi realizada por meio de uma adição de aldol Mukaiyama usando formaldeído , a iodação para 11 ( iodo , DMAP ) foi seguida por um acoplamento de Stille ( Pd 2 dba 3 , Ph 3 As , CuI ) incorporando a unidade de nitrobenzeno 12 . O álcool 13 foi formado após a proteção do SEM (SEMCl, i-Pr2NEt) e a remoção do TIPS ( HF ).
Na segunda parte da sequência, o álcool 13 foi convertido em um triflato ( anidrido triflico , N , N- diisopropiletilamina ), em seguida, 2,2-bis (etiltio) etilamina 14 foi adicionado imediatamente seguido por pó de zinco , estabelecendo uma reação em tandem com redução do grupo nitro à amina, adição de 1,4 do grupo tio-amina e condensação amina-ceto ao indol 16 . A reação com DMTSF deu ataque de tionio em C7 formando 17 , o grupo imina foi então reduzido ( NaBH 3 CN , TiCl 4 ), o novo grupo amino acilado ( anidrido acético , piridina ), ambos os grupos de proteção de álcool removidos ( NaOMe / meOH) e o grupo álcool alílico protegido novamente (TIPS). Isso permitiu a remoção do grupo etiltio ( NiCl 2 , NaBH 4 , EtOH / MeOH) para 18 . O álcool foi oxidado ao aldeído usando uma oxidação Parikh-Doering e a remoção do grupo TIPS deu hemiacetal 19 chamado (+) - diabolina que é aldeído Wieland-Gumlich acilado .
Síntese de li
A síntese relatada por Bodwell / Li (racêmica, 2002) foi uma síntese formal , pois produziu um composto já preparado por Rawal (no. 5 na síntese de Rawal). A etapa principal foi uma reação de Diels-Alder de demanda inversa de elétrons do ciclofano 1 por aquecimento em N , N- dietilanilina (o dinitrogênio é expulso) seguido pela redução da ligação dupla em 2 a 3 por borohidreto de sódio / ácido triflico e remoção do carbamato protetor grupo ( PDC / celite ) a 4 .
O método é contestado por Reissig (ver síntese de Reissig).
Síntese de Fukuyama
A síntese de Fukuyama (quiral (-), 2004) partiu da amina cíclica 1 . A quiralidade foi em algum ponto introduzida neste material de partida por resolução enzimática de um dos precursores. A aciloína 2 foi formada por oxidação e hidrólise de Rubottom . A clivagem oxidativa por acetato de chumbo formado aldeído 3 , a remoção do grupo nosil ( tiofenol / carbonato de césio ) desencadeou uma condensação de amina-carbonila com íon imínio 4 continuando a reagir em uma ciclização transanular para diéster 5 que poderia ser convertido no aldeído Wieland-Gumlich por química conhecida.
Síntese de reissig
O método relatado por Beemelmanns & Reissig (racêmico, 2010) é outra síntese formal que leva ao pentaciclo de Rawal (ver amina 5 no método de Rawal). Neste método, o indol 1 foi convertido em tetraciclo 2 (junto com o subproduto) em uma única reação em cascata usando diiodeto de samário e HMPA . Níquel de Raney / H 2 redução deu amina 3 e uma reacção num só vaso, utilizando cloroformato de metilo , DMAP e TEA em seguida, MsCl , DMAP e de TEA e em seguida DBU deu Rawal precursor 4 com átomos de hidrogénio chave na configuração anti desejado.
Em uma via abortada, o intermediário 2 foi primeiro reduzido a imina 5, depois convertido em carbamato 6 , depois desidratado em dieno 7 ( reagente de Burgess ) e finalmente reduzido a 8 ( cianoboro-hidreto de sódio ). Os átomos de hidrogênio em 8 estão em uma indesejável relação cis, o que contradiz os resultados obtidos em 2002 por Bodwell / Li para a mesma reação.
Síntese de Vanderwal
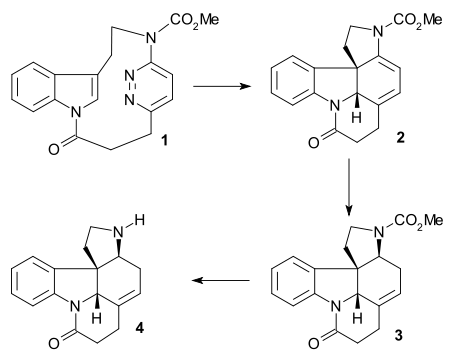
Em 2011, o grupo Vanderwal relatou uma sequência linear mais longa e concisa de 6 etapas, síntese total de estricnina. Ele apresentou uma reação de Zincke seguida por uma reação de biciclização aniônica e um rearranjo de Brook em tandem / adição de conjugado .