Cloreto de tântalo (V) - Tantalum(V) chloride
|
|
| Nomes | |
|---|---|
|
Nomes IUPAC
Cloreto de tântalo (V) Pentacloreto de
tântalo |
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| ECHA InfoCard |
100.028.869 |
| Número EC | |
|
PubChem CID
|
|
| UNII | |
|
Painel CompTox ( EPA )
|
|
|
|
|
|
| Propriedades | |
| TaCl 5 | |
| Massa molar | 358,213 g / mol |
| Aparência | cristais monoclínicos brancos |
| Densidade | 3,68 g / cm 3 |
| Ponto de fusão | 216 ° C (421 ° F; 489 K) |
| Ponto de ebulição | 239,4 ° C (462,9 ° F; 512,5 K) (se decompõe) |
| reage | |
| Solubilidade | clorofórmio , CCl 4 |
| +140,0 × 10 −6 cm 3 / mol | |
| Estrutura | |
| Monoclínico , mS72 | |
| C2 / m, No. 12 | |
| Termoquímica | |
|
Entropia molar padrão ( S |
221,75 J K −1 mol −1 |
| -858,98 kJ / mol | |
| Perigos | |
| Ponto de inflamação | Não inflamável |
| Dose ou concentração letal (LD, LC): | |
|
LD 50 ( dose mediana )
|
1900 mg / kg (oral, rato) |
| Compostos relacionados | |
|
Outros ânions
|
Tântalo (V) fluoreto Tântalo (V) brometo Tântalo (V) iodeto |
|
Outros cátions
|
Cloreto de vanádio (IV) Cloreto de nióbio (V) |
|
Compostos relacionados
|
Cloreto de tântalo (III) , cloreto de tântalo (IV) |
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Referências da Infobox | |
O cloreto de tântalo (V) , também conhecido como pentacloreto de tântalo , é um composto inorgânico com a fórmula TaCl 5 . Ele tem a forma de um pó branco e é comumente usado como material de partida na química do tântalo . Ele prontamente hidrolisa para formar oxicloreto de tântalo (V) (TaOCl 3 ) e, eventualmente, pentóxido de tântalo (Ta 2 O 5 ); isso requer que seja sintetizado e manipulado sob condições anidras , usando técnicas sem ar .
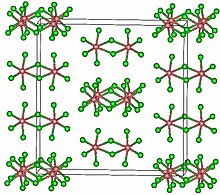
Estrutura
TaCl 5 cristaliza no grupo espacial monoclínico C2 / m . Os dez átomos de cloro definem um par de octaedros que compartilham uma borda comum. Os átomos de tântalo ocupam os centros do octaedro e são unidos por dois ligantes de cloro . A estrutura dimérica é retida em solventes não complexantes e em grande parte no estado fundido. No estado de vapor, entretanto, o TaCl 5 é monomérico . Este monômero adota uma estrutura trigonal bipiramidal , como a do PCl 5 .
Propriedades físicas
A solubilidade do pentacloreto de tântalo aumenta ligeiramente para a seguinte série de hidrocarbonetos aromáticos :
- benzeno < tolueno < m- xileno < mesitileno
Isso se reflete no aprofundamento da cor das soluções de amarelo claro para laranja. O pentacloreto de tântalo é menos solúvel em ciclohexano e tetracloreto de carbono do que nos hidrocarbonetos aromáticos. Essas soluções de pentacloreto de tântalo também são conhecidas por serem maus condutores de eletricidade, indicando pouca ionização. TaCl 5 é purificado por sublimação para dar agulhas brancas.
Síntese
O pentacloreto de tântalo pode ser preparado pela reação de tântalo metálico em pó com cloro gasoso entre 170 e 250 ° C. Esta reação também pode ser realizada usando HCl a 400 ° C.
- 2 Ta + 5 Cl 2 → 2 TaCl 5
- 2 Ta + 10 HCl → 2 TaCl 5 + 5 H 2
Também pode ser preparado por uma reação entre pentóxido de tântalo e cloreto de tionila a 240 ° C
- Ta 2 O 5 + 5 SOCl 2 → 2 TACL 5 + 5 SO 2
O pentacloreto de tântalo está comercialmente disponível, porém as amostras podem estar contaminadas com oxicloreto de tântalo (V) (TaOCl 3 ), formado por hidrólise.
Reações
TaCl 5 é eletrofílico e se comporta como um catalisador de Friedel-Crafts , semelhante ao AlCl 3 . Forma adutos com uma variedade de bases de Lewis .
Adutos simples
TaCl 5 forma complexos estáveis com éteres :
- TaCl 5 + R 2 O → TaCl 5 (OR 2 ) (R = Me, Et)
TaCl 5 também reage com pentacloreto de fósforo e oxicloreto de fósforo , o primeiro como um doador de cloreto e o último serve como um ligante, ligando-se através do oxigênio:
- TaCl 5 + PCl 5 → [ PCl +
4 ] [ TaCl -
6 ] - TaCl 5 + OPCl 3 → [TaCl 5 (OPCl 3 )]
O pentacloreto de tântalo reage com aminas terciárias para dar adutos cristalinos.
- TaCl 5 + 2 R 3 N → [TaCl 5 (NR 3 )]
Reações de deslocamento de cloreto
O pentacloreto de tântalo reage à temperatura ambiente com um excesso de óxido de trifenilfosfina para dar oxicloretos:
- TaCl 5 + 3 OPPh 3 → [TaOCl 3 (OPPh 3 )] x ...
A formação inicial presumida de adutos entre TaCl 5 e compostos hidroxílicos, como álcoois , fenóis e ácidos carboxílicos, é seguida imediatamente pela eliminação de cloreto de hidrogênio e pela formação de ligações Ta – O:
- TaCl 5 + 3 HOEt → TaCl 2 (OEt) 3 + 3 HCl
Na presença de amônia como aceptor de HCl , todos os cinco ligantes de cloreto são deslocados com a formação de Ta (OEt) 5 . Da mesma forma, o TaCl 5 reage com metóxido de lítio em metanol anidro para formar derivados de metoxi relacionados:
- TaCl 5 + 4 LiOMe → Ta (OMe) 4 Cl + 4 LiCl
A amônia irá deslocar a maioria dos ligantes de cloreto de TaCl 5 para dar um cluster. O cloreto é deslocado mais lentamente por aminas primárias ou secundárias, mas a substituição de todos os cinco centros de cloreto por grupos amido foi alcançada pelo uso de dialquilamidas de lítio, conforme ilustrado pela síntese de pentakis (dimetilamido) tântalo :
- TaCl 5 + 5 LiNMe 2 → Ta (NMe 2 ) 5
Com álcoois, o pentacloreto reage para dar alcóxidos . Conforme mostrado para a preparação de etóxido de tântalo (V) , tais reações são frequentemente conduzidas na presença de base:
- 10 EtOH + Ta 2 Cl 10 + 10 NH 3 → Ta 2 (OEt) 10 + 10 NH 4 Cl
O pentacloreto de tântalo é reduzido por heterociclos de nitrogênio, como a piridina .
Redução
A redução do cloreto de tântalo (V) dá clusters aniônicos e neutros, incluindo [Ta 6 Cl 18 ] 4− e [Ta 6 Cl 14 ] (H 2 O) 4 .
Referências
Leitura adicional
- Ozin, GA; Walton, RA (1970). "Espectros vibracionais e estruturas dos complexos 1: 1 de nióbio e tântalo, pentacloretos e pentabrometo de tântalo com aceto-, perdeuterioaceto- e propionitrilos nos estados sólido e em solução e uma análise vibracional das espécies MX 5 , NC · CY 3 ( Y = H ou D) ". J. Chem. Soc. A : 2236–2239. doi : 10.1039 / j19700002236 .
- Bullock, JI; Parrett, FW; Taylor, NJ (1973). "Alguns complexos de haleto de metal-haleto de fósforo-haleto de alquila. Parte II. Reações com pentacloretos de nióbio e tântalo e hexacloreto de tungstênio". J. Chem. Soc., Dalton Trans. (5): 522-524. doi : 10.1039 / DT9730000522 .
- Đorđević, C .; Katović, V. (1970). "Complexos de coordenação de nióbio e tântalo. Parte VIII. Complexos de nióbio (IV), nióbio (V) e tântalo (V) com oxo, halogênio, alcoxi e ligantes 2,2′-bipiridil mistos". J. Chem. Soc. A : 3382–3386. doi : 10.1039 / j19700003382 .
- Cowley, A .; Fairbrother, F .; Scott, N. (1958). "Os halogenetos de nióbio (columbium) e tântalo. Parte V. Complexos de éter dietílico dos pentacloretos e pentabrometos; a solubilidade do pentaiodeto de tântalo em éter". J. Chem. Soc. : 3133–3137. doi : 10.1039 / JR9580003133 .

