Temperatura - Temperature
| Temperatura | |
|---|---|
 Dois termômetros mostrando a temperatura em Celsius e Fahrenheit.
| |
Símbolos comuns |
T |
| Unidade SI | K |
Outras unidades |
° C , ° F , ° R , ° Rø , ° Ré , ° N , ° D , ° L , ° W |
| Intensivo ? | sim |
Derivações de outras quantidades |
, |
| Dimensão | Θ |

| Termodinâmica |
|---|

|
Temperatura ( / t ɛ m p ə r ə t ʃ ə r / TEM-per-UH-cher ) é uma quantidade física que expressa quente e frio. É a manifestação da energia térmica , presente em toda a matéria, que é a fonte da ocorrência do calor , um fluxo de energia, quando um corpo está em contato com outro mais frio ou mais quente.
A temperatura é medida com um termômetro . Os termômetros são calibrados em várias escalas de temperatura que historicamente têm usado vários pontos de referência e substâncias termométricas para definição. As escalas mais comuns são a escala Celsius (anteriormente chamada de centígrados , denotada como ° C), a escala Fahrenheit (denotada como ° F) e a escala Kelvin (denotada como K), a última das quais é predominantemente usada para fins científicos por convenções do Sistema Internacional de Unidades (SI).
A temperatura teórica mais baixa é o zero absoluto , no qual nenhuma energia térmica mais pode ser extraída de um corpo. Experimentalmente, ele só pode ser aproximado (100 pK), mas não alcançado, o que é reconhecido na terceira lei da termodinâmica .
A temperatura é importante em todos os campos das ciências naturais , incluindo física , química , ciências da Terra , astronomia , medicina , biologia , ecologia , ciência dos materiais , metalurgia , engenharia mecânica e geografia , bem como na maioria dos aspectos da vida diária.
Efeitos
Muitos processos físicos estão relacionados à temperatura, alguns deles são apresentados a seguir:
- as propriedades físicas dos materiais, incluindo a fase ( sólida , líquida , gasosa ou plasma ), densidade , solubilidade , pressão de vapor , condutividade elétrica , dureza , resistência ao desgaste , condutividade térmica , resistência à corrosão , força
- a taxa e extensão em que ocorrem as reações químicas
- a quantidade e as propriedades da radiação térmica emitida da superfície de um objeto
- a temperatura do ar afeta todos os organismos vivos
- a velocidade do som, que é função da raiz quadrada da temperatura absoluta.
Balanças
As escalas de temperatura diferem de duas maneiras: o ponto escolhido como zero grau e as magnitudes das unidades ou graus incrementais na escala.
Escalas comumente usadas
A escala Celsius (° C) é usada para medições de temperatura comuns na maior parte do mundo. É uma escala empírica que foi desenvolvida pelo progresso histórico, que levou ao seu ponto zero.0 ° C sendo definido pelo ponto de congelamento da água, e graus adicionais definidos de modo que100 ° C era o ponto de ebulição da água, ambos à pressão atmosférica ao nível do mar . Por causa do intervalo de 100 graus, foi chamado de escala centígrada. Desde a padronização do Kelvin no Sistema Internacional de Unidades, ele foi posteriormente redefinido em termos de pontos de fixação equivalentes na escala Kelvin, e de modo que um incremento de temperatura de um grau Celsius é o mesmo que um incremento de um Kelvin, embora eles difiram por um deslocamento aditivo de aproximadamente 273,15.
Os Estados Unidos costumam usar a escala Fahrenheit , na qual a água congela em32 ° F e ferve em212 ° F à pressão atmosférica ao nível do mar.
Zero absoluto
No zero absoluto da temperatura, nenhuma energia pode ser removida da matéria como calor, um fato expresso na terceira lei da termodinâmica . Nessa temperatura, a matéria não contém energia térmica macroscópica, mas ainda tem energia de ponto zero da mecânica quântica, conforme previsto pelo princípio da incerteza , embora isso não entre na definição de temperatura absoluta. Experimentalmente, o zero absoluto pode ser aproximado apenas muito de perto; ela nunca pode ser alcançada (a temperatura mínima atingida pelo experimento é 100 pK). Teoricamente, em um corpo à temperatura zero absoluta, todo o movimento clássico de suas partículas cessou e elas estão em repouso completo neste sentido clássico. O zero absoluto, definido como0 K , é aproximadamente igual a-273,15 ° C , ou-459,67 ° F .
Escalas absolutas
Referindo-se à constante de Boltzmann , à distribuição de Maxwell-Boltzmann e à definição mecânica estatística de Boltzmann de entropia , diferente da definição de Gibbs, para partículas microscópicas em movimento independente, desconsiderando a energia potencial interpartícula, por acordo internacional, uma escala de temperatura é definida e dito ser absoluto porque é independente das características de determinadas substâncias termométricas e mecanismos de termômetro. Além do zero absoluto, não possui temperatura de referência. É conhecida como escala Kelvin , amplamente utilizada na ciência e tecnologia. O kelvin (a palavra é escrita com um k minúsculo ) é a unidade de temperatura no Sistema Internacional de Unidades (SI). A temperatura de um corpo em seu próprio estado de equilíbrio termodinâmico é sempre positiva, em relação ao zero absoluto .
Além da escala Kelvin internacionalmente aceita, há também uma escala de temperatura termodinâmica , inventada por Lord Kelvin , também com seu zero numérico no zero absoluto da temperatura, mas diretamente relacionado a conceitos termodinâmicos puramente macroscópicos , incluindo a entropia macroscópica , embora microscopicamente referenciada a a definição mecânica estatística de Gibbs de entropia para o conjunto canônico , que leva em conta a energia potencial interpartícula, bem como o movimento de partícula independente para que possa levar em conta medições de temperaturas próximas do zero absoluto. Esta escala tem uma temperatura de referência no ponto triplo da água, cujo valor numérico é definido por medições usando a já mencionada escala Kelvin internacionalmente acordada.
Escala Kelvin Internacional
Muitas medições científicas usam a escala de temperatura Kelvin (símbolo da unidade: K), nomeada em homenagem ao físico que a definiu pela primeira vez . É uma escala absoluta . Seu ponto zero numérico,0 K , está no zero absoluto da temperatura. Desde maio de 2019, seus graus são definidos através da teoria cinética de partículas e mecânica estatística. No Sistema Internacional de Unidades (SI), a magnitude do Kelvin é definida por meio de várias medições empíricas da energia cinética média de partículas microscópicas. É avaliada numericamente em termos da constante de Boltzmann , cujo valor é definido como fixado por convenção internacional.
Escalas estatísticas de temperatura mecânica versus termodinâmica
Desde maio de 2019, a magnitude do Kelvin é definida em relação a fenômenos microscópicos, caracterizados em termos de mecânica estatística. Anteriormente, desde 1954, o Sistema Internacional de Unidades definiu uma escala e unidade para o Kelvin como uma temperatura termodinâmica , usando a temperatura reproduzível de forma confiável do ponto triplo da água como um segundo ponto de referência, sendo o primeiro ponto de referência0 K em zero absoluto.
Historicamente, o ponto triplo da temperatura da água foi definido como exatamente 273,16 unidades do incremento de medição. Hoje é uma quantidade medida empiricamente. O ponto de congelamento da água na pressão atmosférica ao nível do mar ocorre em aproximadamente273,15 K =0 ° C .
Classificação das escalas
Existem vários tipos de escalas de temperatura. Pode ser conveniente classificá-los como embasados empiricamente e teoricamente. As escalas de temperatura empíricas são historicamente mais antigas, enquanto as escalas baseadas na teoria surgiram em meados do século XIX.
Escalas empíricas
Escalas de temperatura com base empírica dependem diretamente de medições de propriedades físicas macroscópicas simples dos materiais. Por exemplo, o comprimento de uma coluna de mercúrio, confinada em um tubo capilar com parede de vidro, depende muito da temperatura e é a base do termômetro de mercúrio em vidro muito útil. Essas escalas são válidas apenas dentro de faixas convenientes de temperatura. Por exemplo, acima do ponto de ebulição do mercúrio, um termômetro de mercúrio em vidro é impraticável. A maioria dos materiais se expande com o aumento da temperatura, mas alguns materiais, como a água, se contraem com o aumento da temperatura em uma faixa específica e, então, dificilmente são úteis como materiais termométricos. Um material não serve como termômetro perto de uma de suas temperaturas de mudança de fase, por exemplo, seu ponto de ebulição.
Apesar dessas limitações, os termômetros práticos mais geralmente usados são do tipo com base empírica. Especialmente, foi usado para calorimetria , o que contribuiu muito para a descoberta da termodinâmica. No entanto, a termometria empírica tem sérias desvantagens quando julgada como uma base para a física teórica. Termômetros com base empírica, além de sua base como simples medições diretas de propriedades físicas comuns de materiais termométricos, podem ser recalibrados, pelo uso de raciocínio físico teórico, e isso pode estender sua faixa de adequação.
Escalas teóricas
Escalas de temperatura com base teórica são baseadas diretamente em argumentos teóricos, especialmente aqueles da teoria cinética e da termodinâmica. Eles são mais ou menos idealmente realizados em materiais e dispositivos físicos viáveis. Escalas de temperatura com base teórica são usadas para fornecer padrões de calibração para termômetros práticos com base empírica.
Escala mecânica estatística microscópica
Em física, a escala de temperatura convencional aceita internacionalmente é chamada de escala Kelvin. É calibrado por meio do valor da constante de Boltzmann acordado e prescrito internacionalmente, referente aos movimentos de partículas microscópicas, como átomos, moléculas e elétrons, constituintes do corpo cuja temperatura se deseja medir. Em contraste com a escala de temperatura termodinâmica inventada por Kelvin, a temperatura Kelvin atualmente convencional não é definida por comparação com a temperatura de um estado de referência de um corpo padrão, nem em termos de termodinâmica macroscópica.
Além do zero absoluto da temperatura, a temperatura Kelvin de um corpo em um estado de equilíbrio termodinâmico interno é definida por medições de propriedades físicas escolhidas de maneira adequada, tais como explicações teóricas precisamente conhecidas em termos da constante de Boltzmann . Essa constante se refere a tipos escolhidos de movimento de partículas microscópicas na constituição do corpo. Nesses tipos de movimento, as partículas se movem individualmente, sem interação mútua. Esses movimentos são normalmente interrompidos por colisões entre partículas, mas para medição de temperatura, os movimentos são escolhidos de modo que, entre as colisões, os segmentos não interativos de suas trajetórias sejam conhecidos por serem acessíveis para medição precisa. Para isso, a energia potencial interpartícula é desconsiderada.
Em um gás ideal , e em outros corpos teoricamente entendidos, a temperatura Kelvin é definida como sendo proporcional à energia cinética média de partículas microscópicas que não se movem interativamente, que podem ser medidas por técnicas adequadas. A constante de proporcionalidade é um múltiplo simples da constante de Boltzmann. Se moléculas, átomos ou elétrons são emitidos do material e suas velocidades são medidas, o espectro de suas velocidades quase sempre obedece a uma lei teórica chamada distribuição de Maxwell-Boltzmann , que fornece uma medida bem fundamentada de temperaturas para as quais a lei se aplica . Ainda não houve experimentos bem-sucedidos desse mesmo tipo que usam diretamente a distribuição Fermi-Dirac para termometria, mas talvez isso seja alcançado no futuro.
A velocidade do som em um gás pode ser calculada teoricamente a partir do caráter molecular do gás, de sua temperatura e pressão, e do valor da constante de Boltzmann. Para um gás de caráter molecular e pressão conhecidos, isso fornece uma relação entre a temperatura e a constante de Boltzmann. Essas quantidades podem ser conhecidas ou medidas com mais precisão do que as variáveis termodinâmicas que definem o estado de uma amostra de água em seu ponto triplo. Consequentemente, tomando o valor da constante de Boltzmann como uma referência definida principalmente de um valor definido exatamente, uma medição da velocidade do som pode fornecer uma medição mais precisa da temperatura do gás.
A medição do espectro de radiação eletromagnética de um corpo negro tridimensional ideal pode fornecer uma medição de temperatura precisa porque a frequência de radiação espectral máxima da radiação de corpo negro é diretamente proporcional à temperatura do corpo negro; isso é conhecido como lei do deslocamento de Wien e tem uma explicação teórica na lei de Planck ea lei de Bose-Einstein .
A medição do espectro de potência de ruído produzida por um resistor elétrico também pode fornecer medições de temperatura precisas. O resistor tem dois terminais e é, na verdade, um corpo unidimensional. A lei de Bose-Einstein para este caso indica que o ruído-potência é diretamente proporcional à temperatura do resistor e ao valor de sua resistência e à largura de banda do ruído. Em uma determinada banda de frequência, a potência do ruído tem contribuições iguais de todas as frequências e é chamada de ruído de Johnson . Se o valor da resistência for conhecido, a temperatura pode ser encontrada.
Escala termodinâmica macroscópica
Historicamente, até maio de 2019, a definição da escala Kelvin era aquela inventada por Kelvin, baseada em uma relação de quantidades de energia em processos em um motor Carnot ideal, inteiramente em termos de termodinâmica macroscópica. Esse motor de Carnot deveria funcionar entre duas temperaturas, a do corpo cuja temperatura seria medida, e uma referência, a de um corpo à temperatura do ponto triplo da água. Em seguida, a temperatura de referência, a do ponto triplo, foi definida para ser exatamente273,16 K . Desde maio de 2019, esse valor não é fixado por definição, mas deve ser medido por meio de fenômenos microscópicos, envolvendo a constante de Boltzmann, conforme descrito acima. A definição mecânica estatística microscópica não tem uma temperatura de referência.
Gás ideal
Um material no qual uma escala de temperatura definida macroscopicamente pode ser baseada é o gás ideal . A pressão exercida por um volume e massa fixos de um gás ideal é diretamente proporcional à sua temperatura. Alguns gases naturais apresentam propriedades tão quase ideais na faixa de temperatura adequada que podem ser usados para termometria; isso foi importante durante o desenvolvimento da termodinâmica e ainda é de importância prática hoje. O termômetro de gás ideal, entretanto, não é teoricamente perfeito para a termodinâmica. Isso ocorre porque a entropia de um gás ideal em seu zero absoluto de temperatura não é uma quantidade semi-definida positiva, o que coloca o gás em violação da terceira lei da termodinâmica. Em contraste com os materiais reais, o gás ideal não se liquefaz ou solidifica, não importa o quão frio esteja. Alternativamente pensando, a lei dos gases ideais, refere-se ao limite de temperatura infinitamente alta e pressão zero; essas condições garantem movimentos não interativos das moléculas constituintes.
Abordagem da teoria cinética
A magnitude do Kelvin agora é definida em termos da teoria cinética, derivada do valor da constante de Boltzmann .
A teoria cinética fornece uma descrição microscópica da temperatura para alguns corpos materiais, especialmente gases, com base em sistemas macroscópicos sendo compostos de muitas partículas microscópicas, como moléculas e íons de várias espécies, as partículas de uma espécie sendo todas semelhantes. Explica fenômenos macroscópicos por meio da mecânica clássica das partículas microscópicas. O teorema da equipartição da teoria cinética afirma que cada grau clássico de liberdade de uma partícula em movimento livre tem uma energia cinética média de k B T / 2, onde k B denota a constante de Boltzmann . O movimento translacional da partícula tem três graus de liberdade, de modo que, exceto em temperaturas muito baixas onde predominam os efeitos quânticos, a energia cinética translacional média de uma partícula em movimento livre em um sistema com temperatura T será de 3 k B T / 2 .
Moléculas , como o oxigênio (O 2 ), têm mais graus de liberdade do que átomos esféricos simples: eles sofrem movimentos rotacionais e vibracionais, bem como translações. O aquecimento resulta em um aumento de temperatura devido a um aumento na energia cinética translacional média das moléculas. O aquecimento também fará com que, por meio de equipartição , a energia associada aos modos vibracional e rotacional aumente. Assim, um gás diatômico exigirá mais entrada de energia para aumentar sua temperatura em uma certa quantidade, ou seja, terá uma capacidade de calor maior do que um gás monoatômico.
Como observado acima, a velocidade do som em um gás pode ser calculada a partir do caráter molecular do gás, de sua temperatura e pressão, e do valor da constante de Boltzmann. Tomando o valor da constante de Boltzmann como uma referência definida principalmente de um valor definido exatamente, uma medição da velocidade do som pode fornecer uma medição mais precisa da temperatura do gás.
É possível medir a energia cinética média das partículas microscópicas constituintes se elas puderem escapar da maior parte do sistema, através de um pequeno orifício na parede de contenção. O espectro de velocidades deve ser medido e a média calculada a partir disso. Não é necessariamente o caso de que as partículas que escapam e são medidas tenham a mesma distribuição de velocidade que as partículas que permanecem na maior parte do sistema, mas às vezes uma boa amostra é possível.
Abordagem termodinâmica
A temperatura é uma das principais grandezas no estudo da termodinâmica . Antigamente, a magnitude do Kelvin era definida em termos termodinâmicos, mas hoje em dia, como mencionado acima, é definida em termos de teoria cinética.
A temperatura termodinâmica é considerada absoluta por duas razões. Uma é que seu caráter formal é independente das propriedades de materiais específicos. A outra razão é que seu zero é, em certo sentido, absoluto, na medida em que indica ausência de movimento clássico microscópico das partículas constituintes da matéria, de modo que elas têm um calor específico limite de zero para temperatura zero, de acordo com a terceira lei. da termodinâmica. Não obstante, uma temperatura termodinâmica tem de fato um valor numérico definido que foi escolhido arbitrariamente pela tradição e depende da propriedade de materiais particulares; é simplesmente menos arbitrário do que escalas de "graus" relativos, como Celsius e Fahrenheit . Sendo uma escala absoluta com um ponto fixo (zero), há apenas um grau de liberdade deixado para escolha arbitrária, ao invés de dois como em escalas relativas. Para a escala Kelvin desde maio de 2019, por convenção internacional, optou-se por utilizar o conhecimento dos modos de operação de diversos dispositivos termométricos, baseando-se em teorias cinéticas microscópicas sobre o movimento molecular. A escala numérica é estabelecida por uma definição convencional do valor da constante de Boltzmann , que relaciona a temperatura macroscópica à energia cinética microscópica média de partículas, como moléculas. Seu valor numérico é arbitrário e existe uma escala de temperatura absoluta alternativa, menos usada, chamada escala Rankine , feita para ser alinhada com a escala Fahrenheit como Kelvin está com Celsius .
A definição termodinâmica de temperatura é devida a Kelvin. É enquadrado em termos de um dispositivo idealizado chamado de motor de Carnot , imaginado para funcionar em um ciclo contínuo fictício de processos sucessivos que percorrem um ciclo de estados de seu corpo de trabalho. O motor recebe uma quantidade de calor Q 1 de um reservatório quente e passa uma quantidade menor de calor Q 2 para um reservatório frio. A diferença de energia é passada, como trabalho termodinâmico, para um reservatório de trabalho, e é considerada a saída do motor. O ciclo é imaginado para correr tão lentamente que em cada ponto do ciclo o corpo de trabalho está em um estado de equilíbrio termodinâmico. Os sucessivos processos do ciclo são, portanto, imaginados como ocorrendo de forma reversível, sem produção de entropia. Então, a quantidade de entropia retirada do reservatório quente quando o corpo de trabalho é aquecido é igual à passada para o reservatório frio quando o corpo de trabalho é resfriado. Em seguida, as temperaturas absolutas ou termodinâmicas, T 1 e T 2 , dos reservatórios são definidos de modo que seja tal que
-
(1)
A lei zero da termodinâmica permite que esta definição seja usada para medir a temperatura absoluta ou termodinâmica de um corpo arbitrário de interesse, fazendo com que o outro reservatório de calor tenha a mesma temperatura do corpo de interesse.
O trabalho original de Kelvin postulando a temperatura absoluta foi publicado em 1848. Ele foi baseado no trabalho de Carnot, antes da formulação da primeira lei da termodinâmica. Carnot não tinha uma compreensão sólida de calor e nenhum conceito específico de entropia. Ele escreveu sobre 'calórico' e disse que todo o calórico que passou do reservatório quente foi passado para o reservatório frio. Kelvin escreveu em seu artigo de 1848 que sua escala era absoluta no sentido de que foi definida "independentemente das propriedades de qualquer tipo particular de matéria". Sua publicação definitiva, que expõe a definição que acabamos de enunciar, foi impressa em 1853, artigo lido em 1851.
Os detalhes numéricos eram anteriormente determinados fazendo um dos reservatórios de calor uma célula no ponto triplo da água, que foi definida para ter uma temperatura absoluta de 273,16 K. Hoje em dia, o valor numérico é obtido a partir da medição através da definição internacional mecânica estatística microscópica , como acima.
Variabilidade intensiva
Em termos termodinâmicos, a temperatura é uma variável intensiva porque é igual a um coeficiente diferencial de uma variável extensa em relação a outra, para um determinado corpo. Portanto, tem as dimensões de uma razão de duas variáveis extensas. Em termodinâmica, dois corpos são frequentemente considerados como conectados pelo contato com uma parede comum, que tem algumas propriedades de permeabilidade específicas. Essa permeabilidade específica pode ser referida a uma variável intensiva específica. Um exemplo é uma parede diatérmica permeável apenas ao calor; a variável intensiva para este caso é a temperatura. Quando os dois corpos foram conectados através da parede especificamente permeável por um longo tempo, e se estabeleceram em um estado estacionário permanente, as variáveis intensivas relevantes são iguais nos dois corpos; para uma parede diatérmica, essa afirmação às vezes é chamada de lei zero da termodinâmica.
Em particular, quando o corpo é descrito pela declaração de sua energia interna U , uma variável extensa, em função de sua entropia S , também uma variável extensa, e outras variáveis de estado V , N , com U = U ( S , V , N ), então a temperatura é igual à derivada parcial da energia interna em relação à entropia:
-
(2)
Da mesma forma, quando o corpo é descrito declarando sua entropia S como uma função de sua energia interna U , e outras variáveis de estado V , N , com S = S ( U , V , N ) , então o recíproco da temperatura é igual a a derivada parcial da entropia em relação à energia interna:
-
(3)
A definição acima, equação (1), da temperatura absoluta, é devida a Kelvin. Refere-se a sistemas fechados à transferência de matéria e tem uma ênfase especial em procedimentos experimentais diretos. Uma apresentação da termodinâmica por Gibbs começa em um nível mais abstrato e trata de sistemas abertos à transferência de matéria; neste desenvolvimento da termodinâmica, as equações (2) e (3) acima são, na verdade, definições alternativas de temperatura.
Equilíbrio termodinâmico local
Corpos do mundo real muitas vezes não estão em equilíbrio termodinâmico e não são homogêneos. Para o estudo pelos métodos da termodinâmica irreversível clássica, um corpo é geralmente espacial e temporalmente dividido conceitualmente em "células" de pequeno tamanho. Se as condições clássicas de equilíbrio termodinâmico para a matéria forem satisfeitas com boa aproximação em tal 'célula', então ela é homogênea e existe uma temperatura para ela. Se assim for para todas as "células" do corpo, diz-se que o equilíbrio termodinâmico local prevalece em todo o corpo.
Faz sentido, por exemplo, dizer da variável extensiva U , ou da variável extensiva S , que ela tem uma densidade por unidade de volume ou uma quantidade por unidade de massa do sistema, mas não faz sentido falar da densidade de temperatura por unidade de volume ou quantidade de temperatura por unidade de massa do sistema. Por outro lado, não faz sentido falar da energia interna em um ponto, enquanto quando o equilíbrio termodinâmico local prevalece, faz sentido falar da temperatura em um ponto. Conseqüentemente, a temperatura pode variar de ponto a ponto em um meio que não está em equilíbrio termodinâmico global, mas no qual existe equilíbrio termodinâmico local.
Assim, quando o equilíbrio termodinâmico local prevalece em um corpo, a temperatura pode ser considerada como uma propriedade local espacialmente variável naquele corpo, e isso ocorre porque a temperatura é uma variável intensiva.
Teoria básica
|
Variáveis conjugadas da termodinâmica |
|
|---|---|
| Pressão | Volume |
| ( Estresse ) | ( Tensão ) |
| Temperatura | Entropia |
| Potencial químico | Número de partícula |
A temperatura é a medida da qualidade do estado de um material. A qualidade pode ser considerada uma entidade mais abstrata do que qualquer escala de temperatura particular que a mede, e é chamada de calor por alguns escritores. A qualidade do calor se refere ao estado do material apenas em uma determinada localidade e, em geral, à parte dos corpos mantidos em um estado estacionário de equilíbrio termodinâmico, o calor varia de um lugar para outro. Não é necessariamente o caso de um material em um determinado local estar em um estado estável e quase homogêneo o suficiente para permitir que tenha um calor ou temperatura bem definidos. A gostosura pode ser representada abstratamente como uma variedade unidimensional . Cada escala de temperatura válida tem seu próprio mapa individual no coletor de calor.
Quando dois sistemas em contato térmico estão na mesma temperatura, não há transferência de calor entre eles. Quando existe uma diferença de temperatura, o calor flui espontaneamente do sistema mais quente para o sistema mais frio até que eles estejam em equilíbrio térmico . Essa transferência de calor ocorre por condução ou por radiação térmica.
Físicos experimentais, por exemplo Galileu e Newton , descobriram que existem indefinidamente muitas escalas de temperatura empíricas . No entanto, a lei zero da termodinâmica diz que todos medem a mesma qualidade. Isso significa que, para um corpo em seu próprio estado de equilíbrio termodinâmico interno, todo termômetro corretamente calibrado, de qualquer tipo, que mede a temperatura do corpo, registra uma única e mesma temperatura. Para um corpo que não está em seu próprio estado de equilíbrio termodinâmico interno, diferentes termômetros podem registrar diferentes temperaturas, dependendo respectivamente dos mecanismos de operação dos termômetros.
Corpos em equilíbrio termodinâmico
Para a física experimental, calor significa que, ao comparar quaisquer dois corpos dados em seus respectivos equilíbrios termodinâmicos separados , quaisquer dois termômetros empíricos dados adequadamente com leituras em escala numérica concordarão quanto a qual é o mais quente dos dois corpos dados, ou se eles têm o mesma temperatura. Isso não exige que os dois termômetros tenham uma relação linear entre suas leituras de escala numérica, mas exige que a relação entre suas leituras numéricas seja estritamente monotônica . Uma sensação definida de maior calor pode ser obtida, independentemente da calorimetria , da termodinâmica e das propriedades de materiais particulares, a partir da lei de deslocamento da radiação térmica de Wien : a temperatura de um banho de radiação térmica é proporcional , por uma constante universal, ao frequência do máximo de seu espectro de frequência ; essa frequência é sempre positiva, mas pode ter valores que tendem a zero . A radiação térmica é inicialmente definida para uma cavidade em equilíbrio termodinâmico. Esses fatos físicos justificam uma afirmação matemática de que a gostosura existe em uma variedade unidimensional ordenada . Este é um caráter fundamental da temperatura e dos termômetros para corpos em seu próprio equilíbrio termodinâmico.
Exceto para um sistema que passa por uma mudança de fase de primeira ordem , como o derretimento do gelo, como um sistema fechado recebe calor, sem uma mudança em seu volume e sem uma mudança nos campos de força externos agindo sobre ele, sua temperatura aumenta. Para um sistema que passa por tal mudança de fase tão lentamente que o afastamento do equilíbrio termodinâmico pode ser desprezado, sua temperatura permanece constante enquanto o sistema é fornecido com calor latente . Por outro lado, uma perda de calor de um sistema fechado, sem mudança de fase, sem mudança de volume, e sem uma mudança nos campos de força externos que atuam sobre ele, diminui sua temperatura.
Corpos em estado estacionário, mas não em equilíbrio termodinâmico
Enquanto para corpos em seus próprios estados de equilíbrio termodinâmico, a noção de temperatura requer que todos os termômetros empíricos devem concordar quanto a qual dos dois corpos é o mais quente ou que eles estão na mesma temperatura, este requisito não é seguro para corpos estáveis estados, embora não em equilíbrio termodinâmico. Então, pode ser que diferentes termômetros empíricos discordem sobre qual é mais quente e, se for assim, pelo menos um dos corpos não tem uma temperatura termodinâmica absoluta bem definida. No entanto, qualquer pessoa deu corpo e qualquer termômetro empírico adequado ainda pode suportar noções de empírico, não absoluto, calor e temperatura, para uma gama adequada de processos. Este é um assunto para estudo em termodinâmica de não equilíbrio .
Corpos não em estado estacionário
Quando um corpo não está em um estado estacionário, a noção de temperatura torna-se ainda menos segura do que para um corpo em um estado estacionário sem equilíbrio termodinâmico. Este também é um assunto para estudo em termodinâmica de não equilíbrio .
Axiomática de equilíbrio termodinâmico
Para o tratamento axiomático do equilíbrio termodinâmico, desde os anos 1930, tornou-se costume referir-se à lei zero da termodinâmica . A versão minimalista habitualmente declarada de tal lei postula apenas que todos os corpos, que quando conectados termicamente estariam em equilíbrio térmico, deveriam ter a mesma temperatura por definição, mas por si só não estabelece a temperatura como uma quantidade expressa como um valor real número em uma escala. Uma versão fisicamente mais informativa de tal lei vê a temperatura empírica como um gráfico em um coletor de calor. Enquanto a lei zero permite a definição de muitas escalas empíricas diferentes de temperatura, a segunda lei da termodinâmica seleciona a definição de uma única temperatura preferida, absoluta , única até um fator de escala arbitrário, daí a chamada temperatura termodinâmica . Se a energia interna for considerada uma função do volume e da entropia de um sistema homogêneo em equilíbrio termodinâmico, a temperatura termodinâmica absoluta aparece como a derivada parcial da energia interna em relação à entropia em volume constante. Sua origem natural intrínseca ou ponto nulo é o zero absoluto, no qual a entropia de qualquer sistema é mínima. Embora esta seja a temperatura absoluta mais baixa descrita pelo modelo, a terceira lei da termodinâmica postula que o zero absoluto não pode ser alcançado por nenhum sistema físico.
Capacidade de calor
Quando uma transferência de energia de ou para um corpo é apenas como calor, o estado do corpo muda. Dependendo dos arredores e das paredes que os separam do corpo, várias mudanças são possíveis no corpo. Eles incluem reações químicas, aumento de pressão, aumento de temperatura e mudança de fase. Para cada tipo de mudança sob condições especificadas, a capacidade de calor é a relação entre a quantidade de calor transferida e a magnitude da mudança.
Por exemplo, se a mudança é um aumento da temperatura em volume constante, sem mudança de fase e sem mudança química, então a temperatura do corpo aumenta e sua pressão aumenta. A quantidade de calor transferido, Δ Q , dividido pela mudança de temperatura observada, Δ T , é a capacidade de calor do corpo em volume constante:
Se a capacidade de calor é medida para uma quantidade bem definida de substância , o calor específico é a medida do calor necessária para aumentar a temperatura dessa quantidade unitária em uma unidade de temperatura. Por exemplo, aumentar a temperatura da água em um kelvin (igual a um grau Celsius) requer 4186 joules por quilograma (J / kg).
Medição
A medição da temperatura usando termômetros científicos modernos e escalas de temperatura remonta pelo menos ao início do século 18, quando Gabriel Fahrenheit adaptou um termômetro (mudando para mercúrio ) e uma escala desenvolvida por Ole Christensen Rømer . A escala de Fahrenheit ainda é usada nos Estados Unidos para aplicações não científicas.
A temperatura é medida com termômetros que podem ser calibrados para uma variedade de escalas de temperatura . Na maior parte do mundo (exceto em Belize , Mianmar , Libéria e nos Estados Unidos ), a escala Celsius é usada para a maioria dos fins de medição de temperatura. A maioria dos cientistas mede a temperatura usando a escala Celsius e a temperatura termodinâmica usando a escala Kelvin , que é o deslocamento da escala Celsius para que seu ponto nulo seja0 K =-273,15 ° C , ou zero absoluto . Muitos campos da engenharia nos Estados Unidos, notadamente alta tecnologia e especificações federais dos Estados Unidos (civis e militares), também usam as escalas Kelvin e Celsius. Outros campos de engenharia nos EUA também contam com a escala Rankine (uma escala Fahrenheit alterada) ao trabalhar em disciplinas relacionadas à termodinâmica, como combustão .
Unidades
A unidade básica de temperatura no Sistema Internacional de Unidades (SI) é Kelvin . Possui o símbolo K.
Para aplicações diárias, muitas vezes é conveniente usar a escala Celsius, na qual 0 ° C corresponde muito próximo ao ponto de congelamento da água e100 ° C é seu ponto de ebulição ao nível do mar. Como as gotículas de líquido comumente existem nas nuvens em temperaturas abaixo de zero,0 ° C é melhor definido como o ponto de fusão do gelo. Nesta escala, uma diferença de temperatura de 1 grau Celsius é o mesmo que um incremento de 1 Kelvin , mas a escala é compensada pela temperatura na qual o gelo derrete (273,15 K ).
Por acordo internacional, até maio de 2019, as escalas Kelvin e Celsius eram definidas por dois pontos de fixação: o zero absoluto e o ponto triplo da Vienna Standard Mean Ocean Water , que é água especialmente preparada com uma mistura específica de isótopos de hidrogênio e oxigênio. O zero absoluto foi definido com precisão0 K e-273,15 ° C . É a temperatura na qual todo o movimento de translação clássico das partículas que constituem a matéria cessa e elas estão em repouso completo no modelo clássico. Entretanto, na mecânica quântica, o movimento do ponto zero permanece e tem uma energia associada, a energia do ponto zero . A matéria está em seu estado fundamental e não contém energia térmica . As temperaturas273,16 K e0,01 ° C foram definidos como aqueles do ponto triplo da água. Essa definição serviu aos seguintes propósitos: fixou a magnitude do Kelvin como sendo precisamente 1 parte em 273,16 partes da diferença entre o zero absoluto e o ponto triplo da água; estabeleceu que um Kelvin tem precisamente a mesma magnitude que um grau na escala Celsius; e estabeleceu a diferença entre os pontos nulos dessas escalas como sendo273,15 K (0 K =-273,15 ° C e273,16 K =0,01 ° C ). Desde 2019, houve uma nova definição baseada na constante de Boltzmann, mas as escalas quase não são alteradas.
Nos Estados Unidos, a escala Fahrenheit é a mais utilizada. Nesta escala, o ponto de congelamento da água corresponde a32 ° F e o ponto de ebulição para212 ° F . A escala Rankine, ainda usada nos campos da engenharia química nos Estados Unidos, é uma escala absoluta baseada no incremento Fahrenheit.
Conversão
A tabela a seguir mostra as fórmulas de conversão de temperatura para conversões de e para a escala Celsius.
| de Celsius | para Celsius | |
|---|---|---|
| Fahrenheit | [° F] = [° C] × 9 ⁄ 5 + 32 | [° C] = ([° F] - 32) × 5 ⁄ 9 |
| Kelvin | [K] = [° C] + 273,15 | [° C] = [K] - 273,15 |
| Rankine | [° R] = ([° C] + 273,15) × 9 ⁄ 5 | [° C] = ([° R] - 491,67) × 5 ⁄ 9 |
| Delisle | [° De] = (100 - [° C]) × 3 ⁄ 2 | [° C] = 100 - [° De] × 2 ⁄ 3 |
| Newton | [° N] = [° C] × 33 ⁄ 100 | [° C] = [° N] × 100 ⁄ 33 |
| Réaumur | [° Ré] = [° C] × 4 ⁄ 5 | [° C] = [° Ré] × 5 ⁄ 4 |
| Rømer | [° Rø] = [° C] × 21 ⁄ 40 + 7,5 | [° C] = ([° Rø] - 7,5) × 40 ⁄ 21 |
Física do plasma
O campo da física dos plasmas lida com fenômenos de natureza eletromagnética que envolvem temperaturas muito altas. É costume expressar temperatura como energia em unidades de eletronvolts (eV) ou kiloelectronvolts (keV). A energia, que tem uma dimensão diferente da temperatura, é então calculada como o produto da constante de Boltzmann pela temperatura ,. Então, 1 eV corresponde a 11 605 K . No estudo da matéria QCD, encontramos rotineiramente temperaturas da ordem de algumas centenas de MeV , equivalente a cerca de10 12 K .
Fundamentação teórica
Historicamente, existem várias abordagens científicas para a explicação da temperatura: a descrição termodinâmica clássica baseada em variáveis empíricas macroscópicas que podem ser medidas em laboratório; a teoria cinética dos gases, que relaciona a descrição macroscópica à distribuição de probabilidade da energia de movimento das partículas de gás; e uma explicação microscópica baseada em física estatística e mecânica quântica . Além disso, tratamentos rigorosos e puramente matemáticos forneceram uma abordagem axiomática à termodinâmica clássica e à temperatura. A física estatística fornece uma compreensão mais profunda, descrevendo o comportamento atômico da matéria e deriva propriedades macroscópicas de médias estatísticas de estados microscópicos, incluindo estados clássicos e quânticos. Na descrição física fundamental, usando unidades naturais , a temperatura pode ser medida diretamente em unidades de energia. No entanto, nos sistemas práticos de medição para ciência, tecnologia e comércio, como o moderno sistema métrico de unidades, as descrições macroscópica e microscópica são inter-relacionadas pela constante de Boltzmann , um fator de proporcionalidade que escala a temperatura para a energia cinética média microscópica .
A descrição microscópica em mecânica estatística é baseada em um modelo que analisa um sistema em suas partículas fundamentais da matéria ou em um conjunto de osciladores clássicos ou quânticos e considera o sistema como um conjunto estatístico de microestados . Como uma coleção de partículas materiais clássicas, a temperatura é uma medida da energia média do movimento, chamada energia cinética , das partículas, seja em sólidos, líquidos, gases ou plasmas. A energia cinética, um conceito da mecânica clássica , é a metade da massa de uma partícula vezes sua velocidade ao quadrado. Nesta interpretação mecânica do movimento térmico, as energias cinéticas das partículas materiais podem residir na velocidade das partículas de seu movimento translacional ou vibracional ou na inércia de seus modos de rotação. Em gases monoatômicos perfeitos e, aproximadamente, na maioria dos gases, a temperatura é uma medida da energia cinética média da partícula. Ele também determina a função de distribuição de probabilidade de energia. Na matéria condensada, e particularmente em sólidos, esta descrição puramente mecânica é freqüentemente menos útil e o modelo do oscilador fornece uma descrição melhor para explicar os fenômenos da mecânica quântica. A temperatura determina a ocupação estatística dos microestados do conjunto. A definição microscópica de temperatura só é significativa no limite termodinâmico , ou seja, para grandes conjuntos de estados ou partículas, para cumprir os requisitos do modelo estatístico.
A energia cinética também é considerada um componente da energia térmica . A energia térmica pode ser particionada em componentes independentes atribuídos aos graus de liberdade das partículas ou aos modos de osciladores em um sistema termodinâmico . Em geral, o número desses graus de liberdade que estão disponíveis para o equiparticionamento de energia depende da temperatura, ou seja, da região de energia das interações em consideração. Para os sólidos, a energia térmica está associada principalmente às vibrações de seus átomos ou moléculas sobre sua posição de equilíbrio. Em um gás monoatômico ideal , a energia cinética é encontrada exclusivamente nos movimentos puramente translacionais das partículas. Em outros sistemas, os movimentos vibracionais e rotacionais também contribuem com graus de liberdade.
Teoria cinética dos gases

Maxwell e Boltzmann desenvolveram uma teoria cinética que fornece uma compreensão fundamental da temperatura dos gases. Essa teoria também explica a lei dos gases ideais e a capacidade térmica observada dos gases monoatômicos (ou 'nobres' ).
A lei dos gases ideais é baseada em relações empíricas observadas entre pressão ( p ), volume ( V ) e temperatura ( T ), e foi reconhecida muito antes de a teoria cinética dos gases ser desenvolvida (ver as leis de Boyle e Charles ). A lei do gás ideal afirma:
onde n é o número de moles de gás e R = 8,314 462 618 ... J⋅mol −1 ⋅K −1 é a constante do gás .
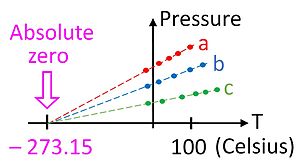
Essa relação nos dá nossa primeira sugestão de que existe um zero absoluto na escala de temperatura, porque ele só se mantém se a temperatura for medida em uma escala absoluta como a de Kelvin. A lei dos gases ideais permite medir a temperatura nesta escala absoluta usando o termômetro de gás . A temperatura em kelvins pode ser definida como a pressão em pascais de um mol de gás em um recipiente de um metro cúbico, dividida pela constante do gás.
Embora não seja um dispositivo particularmente conveniente, o termômetro de gás fornece uma base teórica essencial pela qual todos os termômetros podem ser calibrados. Na prática, não é possível usar um termômetro de gás para medir a temperatura zero absoluta, pois os gases tendem a se condensar em um líquido muito antes de a temperatura chegar a zero. É possível, entretanto, extrapolar para o zero absoluto usando a lei dos gases ideais, conforme mostrado na figura.
A teoria cinética assume que a pressão é causada pela força associada com átomos individuais batendo nas paredes, e que toda energia é energia cinética translacional . Usando um argumento de simetria sofisticado, Boltzmann deduziu o que agora é chamado de função de distribuição de probabilidade de Maxwell-Boltzmann para a velocidade das partículas em um gás ideal. A partir dessa função de distribuição de probabilidade , a energia cinética média (por partícula) de um gás monoatômico ideal é
onde a constante de Boltzmann k B é a constante de gás ideal dividida pelo número de Avogadro , e é a velocidade quadrática média . Essa proporcionalidade direta entre a temperatura e a energia cinética molecular média é um caso especial do teorema da equipartição e se mantém apenas no limite clássico de um gás perfeito . Não é exatamente válido para a maioria das substâncias.
Lei zero da termodinâmica
Quando dois corpos, de outra forma isolados, estão conectados por um caminho físico rígido impermeável à matéria, ocorre a transferência espontânea de energia como calor do mais quente para o mais frio deles. Eventualmente, eles alcançam um estado de equilíbrio térmico mútuo , no qual a transferência de calor cessa e as respectivas variáveis de estado dos corpos se estabilizam e se tornam imutáveis.
Uma afirmação da lei zero da termodinâmica é que, se dois sistemas estão cada um em equilíbrio térmico com um terceiro sistema, eles também estão em equilíbrio térmico um com o outro.
Esta declaração ajuda a definir a temperatura, mas não completa, por si só, a definição. Uma temperatura empírica é uma escala numérica para o calor de um sistema termodinâmico. Tal calor pode ser definido como existente em uma variedade unidimensional , estendendo-se entre o quente e o frio. Às vezes, afirma-se que a lei zero inclui a existência de uma variedade única de calor universal e de escalas numéricas nela, de modo a fornecer uma definição completa de temperatura empírica. Para ser adequado para termometria empírica, um material deve ter uma relação monotônica entre calor e alguma variável de estado facilmente medida, como pressão ou volume, quando todas as outras coordenadas relevantes são fixas. Um sistema excepcionalmente adequado é o gás ideal , que pode fornecer uma escala de temperatura que corresponda à escala Kelvin absoluta. A escala Kelvin é definida com base na segunda lei da termodinâmica.
Segunda lei da termodinâmica
Como alternativa para considerar ou definir a lei zero da termodinâmica, foi o desenvolvimento histórico da termodinâmica definir a temperatura em termos da segunda lei da termodinâmica, que trata da entropia . A segunda lei afirma que qualquer processo resultará em nenhuma mudança ou em um aumento líquido na entropia do universo. Isso pode ser entendido em termos de probabilidade.
Por exemplo, em uma série de sorteios, um sistema perfeitamente ordenado seria aquele em que cada lance dá cara ou cada lance dá coroa. Isso significa que o resultado é sempre 100% o mesmo resultado. Em contraste, muitos resultados mistos ( desordenados ) são possíveis, e seu número aumenta a cada lançamento. Eventualmente, as combinações de ~ 50% cara e ~ 50% coroa dominam, e obter um resultado significativamente diferente de 50/50 torna-se cada vez mais improvável. Assim, o sistema progride naturalmente para um estado de desordem ou entropia máxima.
Como a temperatura governa a transferência de calor entre dois sistemas e o universo tende a progredir em direção a um máximo de entropia, espera-se que haja alguma relação entre temperatura e entropia. Uma máquina térmica é um dispositivo para converter energia térmica em energia mecânica, resultando no desempenho do trabalho. e a análise do motor térmico de Carnot fornece as relações necessárias. O trabalho de um motor de calor corresponde à diferença entre o posto de calor no sistema, à temperatura elevada, q H e o calor extraído a uma temperatura baixa, q C .
A eficiência é o trabalho dividido pela entrada de calor:
-
(4)
onde w cy é o trabalho realizado por ciclo. A eficiência depende apenas q C / q H . Como q C e q H correspondem à transferência de calor nas temperaturas T C e T H respectivamente, q C / q H deve ser alguma função dessas temperaturas:
-
(5)
O teorema de Carnot afirma que todos os motores reversíveis operando entre os mesmos reservatórios de calor são igualmente eficientes. Assim, uma máquina térmica operando entre T 1 e T 3 deve ter a mesma eficiência que uma que consiste em dois ciclos, um entre T 1 e T 2 , e a segunda entre T 2 e T 3 . Isso só pode ser o caso se
que implica
Uma vez que a primeira função é independente de T 2 , esta temperatura deve cancelar no lado direito, o que significa que f ( T 1 , T 3 ) é da forma g ( T 1 ) / g ( T 3 ) (ou seja, f ( T 1 , T 3 ) = f ( T 1 , T 2 ) f ( T 2 , T 3 ) = g ( T 1 ) / g ( T 2 ) · g ( T 2 ) / g ( T 3 ) = g ( T 1 ) / g ( T 3 )) , onde g é uma função de uma única temperatura. Uma escala de temperatura agora pode ser escolhida com a propriedade que
-
(6)
Substituir (6) de volta em (4) dá uma relação para a eficiência em termos de temperatura:
-
(7)
Para T C = 0 K, a eficiência é 100% e essa eficiência se torna maior que 100% abaixo de 0 K. Como uma eficiência maior que 100% viola a primeira lei da termodinâmica, isso implica que 0 K é a temperatura mínima possível. Na verdade, a temperatura mais baixa já obtida em um sistema macroscópico foi de 20 nK, que foi alcançada em 1995 no NIST. Subtraindo o lado direito de (5) da parte do meio e reorganizando dá
onde o sinal negativo indica calor ejetado do sistema. Esta relação sugere a existência de uma função de estado, S , definida por
-
(8)
onde o subscrito indica um processo reversível. A mudança desta função de estado em torno de qualquer ciclo é zero, como é necessário para qualquer função de estado. Essa função corresponde à entropia do sistema, que foi descrita anteriormente. Reorganizar (8) dá uma fórmula para a temperatura em termos de elementos fictícios infinitesimais quase reversíveis de entropia e calor:
-
(9)
Para um sistema, onde a entropia S ( E ) é uma função de sua energia E , a temperatura T é dada por
-
(10)
isto é, o recíproco da temperatura é a taxa de aumento da entropia em relação à energia.
Definição da mecânica estatística
A mecânica estatística define a temperatura com base nos graus de liberdade fundamentais de um sistema. A Eq. (10) é a relação definidora de temperatura, onde a entropia é definida (até uma constante) pelo logaritmo do número de microestados do sistema no macroestado dado (conforme especificado no conjunto microcanônico ):
onde é a constante de Boltzmann e N é o número de microestados.
Quando dois sistemas com temperaturas diferentes são colocados em conexão puramente térmica, o calor fluirá do sistema de temperatura mais alta para o de temperatura mais baixa; termodinamicamente, isso é entendido pela segunda lei da termodinâmica: A mudança total na entropia após uma transferência de energia do sistema 1 para o sistema 2 é:
e é, portanto, positivo se
Do ponto de vista da mecânica estatística, o número total de microestados no sistema combinado 1 + sistema 2 é , cujo logaritmo (vezes a constante de Boltzmann) é a soma de suas entropias; assim, um fluxo de calor de alta para baixa temperatura, que traz um aumento na entropia total, é mais provável do que qualquer outro cenário (normalmente é muito mais provável), pois há mais microestados no macroestado resultante.
Temperatura generalizada a partir de estatísticas de partícula única
É possível estender a definição de temperatura até mesmo para sistemas de poucas partículas, como em um ponto quântico . A temperatura generalizada é obtida considerando conjuntos de tempo em vez de conjuntos de espaço de configuração dados em mecânica estatística no caso de troca térmica e de partículas entre um pequeno sistema de férmions ( N até menos de 10) com um sistema de ocupação simples / dupla. O grande conjunto canônico quântico finito , obtido sob as hipóteses de ergodicidade e ortodicidade, permite expressar a temperatura generalizada a partir da razão do tempo médio de ocupação e do sistema de ocupação simples / dupla:
onde E F é a energia de Fermi . Essa temperatura generalizada tende para a temperatura normal quando N vai para o infinito.
Temperatura negativa
Nas escalas de temperatura empíricas que não são referenciadas ao zero absoluto, uma temperatura negativa é uma abaixo do ponto zero da escala usada. Por exemplo, o gelo seco tem uma temperatura de sublimação de−78,5 ° C que é equivalente a-109,3 ° F . Na escala Kelvin absoluta esta temperatura é194,6 K . Nenhum corpo pode ser levado exatamente0 K (a temperatura do corpo idealmente mais frio possível) por qualquer processo finito praticável; isso é uma consequência da terceira lei da termodinâmica .
A teoria cinética internacional da temperatura de um corpo não pode assumir valores negativos. A escala de temperatura termodinâmica, no entanto, não é tão restrita.
Para um corpo material, às vezes pode ser conceitualmente definido, em termos de graus microscópicos de liberdade, a saber, spins de partículas, um subsistema, com uma temperatura diferente da do corpo inteiro. Quando o corpo está em seu próprio estado de equilíbrio termodinâmico interno, as temperaturas de todo o corpo e do subsistema devem ser as mesmas. As duas temperaturas podem diferir quando, pelo trabalho por meio de campos de força impostos externamente, a energia pode ser transferida de e para o subsistema, separadamente do resto do corpo; então, todo o corpo não está em seu próprio estado de equilíbrio termodinâmico interno. Há um limite superior de energia que um subsistema de spin pode atingir.
Considerando que o subsistema está em um estado temporário de equilíbrio termodinâmico virtual, é possível obter uma temperatura negativa na escala termodinâmica. A temperatura termodinâmica é o inverso da derivada da entropia do subsistema em relação à sua energia interna. À medida que a energia interna do subsistema aumenta, a entropia aumenta em algum intervalo, mas eventualmente atinge um valor máximo e começa a diminuir à medida que os estados de energia mais elevados começam a se preencher. No ponto de entropia máxima, a função temperatura mostra o comportamento de uma singularidade , pois a inclinação da função entropia diminui para zero e então torna-se negativa. À medida que a entropia do subsistema atinge seu máximo, sua temperatura termodinâmica vai para infinito positivo, mudando para infinito negativo conforme a inclinação torna-se negativa. Essas temperaturas negativas são mais altas do que qualquer temperatura positiva. Com o tempo, quando o subsistema é exposto ao resto do corpo, que tem uma temperatura positiva, a energia é transferida como calor do subsistema de temperatura negativa para o sistema de temperatura positiva. A temperatura da teoria cinética não é definida para tais subsistemas.
Exemplos
| Temperatura | Comprimento de onda de emissão de pico da radiação de corpo negro |
||
|---|---|---|---|
| Kelvin | Celsius | ||
|
Zero absoluto (precisamente por definição) |
0 K | -273,15 ° C | Não pode ser definido |
| Temperatura do corpo negro do buraco negro no centro de nossa galáxia, Sagitário A * |
17 fK | -273,149 999 999 999 983 ° C | 1,7 × 10 8 km (1,1 UA ) |
| Temperatura mais baixa alcançada |
100 pK | -273,149 999 999 900 ° C | 29 000 km |
| Condensado de Bose-Einstein mais frio |
450 pK | -273,149 999 999 55 ° C | 6400 km |
| Um milikelvin (precisamente por definição) |
0,001 K | -273,149 ° C |
2,897 77 m (rádio, banda FM ) |
|
Fundo de micro-ondas cósmico (medição de 2013) |
2,7260 K | -270,424 ° C |
0,001 063 01 m (microondas com comprimento de onda milimétrico) |
|
Ponto triplo de água (precisamente por definição) |
273,16 K | 0,01 ° C |
10 608 .3 nm (longo comprimento de onda IR ) |
| Ponto de ebulição da água | 373,1339 K | 99,9839 ° C |
7 766 0,03 nm (meados de comprimento de onda IV) |
| Ponto de fusão do ferro | 1811 K | 1538 ° C |
1600 nm ( infravermelho distante ) |
| Lâmpada incandescente | 2500 K | ≈2200 ° C |
1160 nm ( infravermelho próximo ) |
| Superfície visível do sol | 5778 K | 5505 ° C |
501,5 nm ( luz verde-azul ) |
|
Canal de raio |
28 kK | 28 000 ° C |
100 nm ( luz ultravioleta distante ) |
| Núcleo do sol | 16 MK | 16 milhões ° C | 0,18 nm ( raios X ) |
|
Arma termonuclear (temperatura de pico) |
350 MK | 350 milhões ° C | 8,3 × 10 −3 nm ( raios gama ) |
| Máquina Z da Sandia National Labs |
2 GK | 2 bilhões ° C | 1,4 × 10 −3 nm (raios gama) |
| Núcleo de uma estrela de grande massa em seu último dia |
3 GK | 3 bilhões ° C | 1 × 10 −3 nm (raios gama) |
| Mesclando o sistema
estelar binário de nêutrons |
350 GK | 350 bilhões ° C |
8 × 10 -6 nm (raios gama) |
|
Colisor Relativístico de Íons Pesados |
1 TK | 1 trilhão ° C |
3 × 10 -6 nm (raios gama) |
|
Colisões de prótons e núcleos do CERN |
10 TK | 10 trilhões ° C |
3 × 10 -7 nm (raios gama) |
| Universo 5,391 × 10 −44 s após o Big Bang |
1,417 × 10 32 K ( temperatura de Planck ) |
1,417 × 10 32 ° C |
1,616 × 10 −27 nm ( comprimento de Planck ) |
Veja também
- Temperatura atmosférica
- Temperatura corporal - capacidade de um organismo de manter sua temperatura corporal dentro de certos limites (termorregulação)
- Temperatura de cor - propriedade das fontes de luz relacionadas à radiação do corpo negro
- Temperatura de bulbo seco
- Condução térmica - transferência de energia interna dentro de um corpo devido a colisões de partículas e movimentos de elétrons
- Transferência de calor por convecção
- Registro instrumental de temperatura - medições in situ que fornecem a temperatura do sistema climático da Terra
- ISO 1
- Escala Internacional de Temperatura de 1990 (ITS-90)
- Deflectometria de Schlieren a laser
- Lista de cidades por temperatura média
- Demônio de Maxwell - experimento mental de 1867
- Ordens de magnitude (temperatura) - Faixa de temperaturas de zero absoluto a muito alta
- Temperatura do ar externo
- Temperatura de Planck
- Escala de Rankine - escala de temperatura absoluta em graus Fahrenheit
- Condução de calor relativística - A modelagem da condução de calor e processos de difusão semelhantes de uma forma compatível com a relatividade especial.
- Medições de temperatura de satélite
- Escala de temperatura
- Temperatura da superfície do mar - Temperatura da água próxima à superfície do oceano
- Temperatura de estagnação
- Radiação térmica - radiação eletromagnética gerada pelo movimento térmico das partículas
- Termocepção - Estímulo de temperatura inferido de um fluxo de calor e convertido em um sinal molecular
- Temperatura termodinâmica (absoluta) - Medida da temperatura absoluta
- Termografia - Uso de termogramas para estudar a distribuição de calor em estruturas ou regiões
- Termômetro - Dispositivo para medir temperatura
- Temperatura virtual
- Temperatura do globo úmido
- Temperatura do bulbo úmido - Temperatura lida por um termômetro coberto com um pano molhado
Notas e referências
Bibliografia de referências citadas
- Adkins, CJ (1968/1983). Equilibrium Thermodynamics , (1ª edição 1968), terceira edição 1983, Cambridge University Press, Cambridge UK, ISBN 0-521-25445-0 .
- Buchdahl, HA (1966). The Concepts of Classical Thermodynamics , Cambridge University Press, Cambridge.
- Jaynes, ET (1965). Entropias de Gibbs vs Boltzmann, American Journal of Physics , 33 (5), 391-398.
- Middleton, WEK (1966). A History of the Thermometer and your Use in Metrology , Johns Hopkins Press, Baltimore.
- Miller, J (2013). "Resfriando moléculas de maneira optoelétrica" . Física hoje . 66 (1): 12–14. Bibcode : 2013PhT .... 66a..12M . doi : 10.1063 / pt.3.1840 . Arquivado do original em 15/05/2016.
- Partington, JR (1949). Um Tratado Avançado sobre Química Física , volume 1, Princípios Fundamentais. The Properties of Gases , Longmans, Green & Co., London, pp. 175-177.
- Pippard, AB (1957/1966). Elementos de Termodinâmica Clássica para Estudantes Avançados de Física , publicação original 1957, reimpressão 1966, Cambridge University Press, Cambridge UK.
- Quinn, TJ (1983). Temperature , Academic Press, London, ISBN 0-12-569680-9 .
- Schooley, JF (1986). Thermometry , CRC Press, Boca Raton, ISBN 0-8493-5833-7 .
- Roberts, JK, Miller, AR (1928/1960). Heat and Thermodynamics , (primeira edição 1928), quinta edição, Blackie & Son Limited, Glasgow.
- Thomson, W. (Lord Kelvin) (1848). Em uma escala termométrica absoluta fundada na teoria de Carnot da força motriz do calor e calculada a partir das observações de Regnault, Proc. Camb. Phil. Soc. (1843/1863) 1 , No. 5: 66–71.
- Thomson, W. (Lord Kelvin) (março de 1851). "Sobre a teoria dinâmica do calor, com resultados numéricos deduzidos do equivalente de uma unidade térmica do Sr. Joule e das observações do Sr. Regnault sobre o vapor". Transações da Royal Society of Edinburgh . XX (parte II): 261-268, 289-298.
- Truesdell, CA (1980). The Tragicomical History of Thermodynamics, 1822-1854 , Springer, New York, ISBN 0-387-90403-4 .
- Tschoegl, NW (2000). Fundamentals of Equilibrium and Steady-State Thermodynamics , Elsevier, Amsterdam, ISBN 0-444-50426-5 .
- Zeppenfeld, M .; Englert, BGU; Glöckner, R .; Prehn, A .; Mielenz, M .; Sommer, C .; van Buuren, LD; Motsch, M .; Rempe, G. (2012). "Resfriamento Sysiphus de moléculas poliatômicas eletricamente aprisionadas". Nature . 491 (7425): 570–573. arXiv : 1208,0046 . Bibcode : 2012Natur.491..570Z . doi : 10.1038 / nature11595 . PMID 23151480 . S2CID 4367940 .
Leitura adicional
- Chang, Hasok (2004). Temperatura de invenção: medição e progresso científico . Oxford: Oxford University Press. ISBN 978-0-19-517127-3 .
- Zemansky, Mark Waldo (1964). Temperaturas muito baixas e muito altas . Princeton, NJ: Van Nostrand.