Titulação - Titration
A titulação (também conhecida como titulação e análise volumétrica ) é um método laboratorial comum de análise química quantitativa para determinar a concentração de um analito identificado (uma substância a ser analisada). Um reagente , denominado titulante ou titulador , é preparado como uma solução padrão de concentração e volume conhecidos. O titulante reage com uma solução de analito (que também pode ser denominado titulante ) para determinar a concentração do analito. O volume de titulante que reagiu com o analito é denominado volume de titulação .
História e etimologia
A palavra "titulação" descende da palavra francesa tiltre (1543), significando a proporção de ouro ou prata em moedas ou em obras de ouro ou prata; ou seja, uma medida de pureza ou pureza. Tiltre tornou-se titre , que passou a significar a "pureza do ouro com liga" e, a seguir, a "concentração de uma substância em uma determinada amostra". Em 1828, o químico francês Joseph Louis Gay-Lussac usou pela primeira vez titre como verbo ( titulador ), que significa "determinar a concentração de uma substância em uma determinada amostra".
A análise volumétrica se originou na França do final do século 18. François-Antoine-Henri Descroizilles ( fr ) desenvolveu a primeira bureta (que era semelhante a um cilindro graduado) em 1791. Gay-Lussac desenvolveu uma versão melhorada da bureta que incluía um braço lateral e inventou os termos " pipeta " e " bureta "em um artigo de 1824 sobre a padronização de soluções de índigo. A primeira bureta verdadeira foi inventada em 1845 pelo químico francês Étienne Ossian Henry (1798-1873). Uma grande melhoria do método e popularização da análise volumétrica foi devido a Karl Friedrich Mohr , que redesenhou a bureta em uma forma simples e conveniente, e que escreveu o primeiro livro sobre o assunto, Lehrbuch der chemisch-analytischen Titrirmethode ( Livro de química analítica métodos de titulação ), publicado em 1855.
Procedimento
Uma titulação típica começa com um copo ou frasco Erlenmeyer contendo uma quantidade muito precisa do analito e uma pequena quantidade de indicador (como fenolftaleína ) colocado embaixo de uma bureta calibrada ou seringa de pipetagem química contendo o titulante. Pequenos volumes do titulante são então adicionados ao analito e ao indicador até que o indicador mude de cor em reação ao limite de saturação do titulante, representando a chegada ao ponto final da titulação, o que significa que a quantidade de titulante equilibra a quantidade de analito presente, de acordo com o reação entre os dois. Dependendo do ponto final desejado, gotas únicas ou menos que uma única gota do titulante podem fazer a diferença entre uma mudança permanente e temporária no indicador.
Técnicas de preparação
Titulações típicas requerem titulante e analito na forma líquida (solução). Embora os sólidos sejam geralmente dissolvidos em uma solução aquosa, outros solventes, como o ácido acético glacial ou o etanol, são usados para fins especiais (como na petroquímica ), especializada em petróleo. Os analitos concentrados são frequentemente diluídos para melhorar a precisão.
Muitas titulações não-ácido-base requerem um pH constante durante a reação. Portanto, uma solução tampão pode ser adicionada à câmara de titulação para manter o pH.
Nos casos em que dois reagentes em uma amostra podem reagir com o titulante e apenas um é o analito desejado, uma solução de mascaramento separada pode ser adicionada à câmara de reação que elimina o efeito do íon indesejado.
Algumas reações de redução-oxidação ( redox ) podem exigir o aquecimento da solução da amostra e a titulação enquanto a solução ainda está quente para aumentar a taxa de reação . Por exemplo, a oxidação de algumas soluções de oxalato requer aquecimento a 60 ° C (140 ° F) para manter uma taxa razoável de reação.
Curvas de titulação
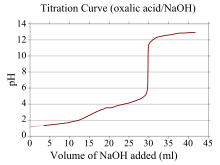
Uma curva de titulação é uma curva no gráfico cuja coordenada x representa o volume de titulante adicionado desde o início da titulação, e a coordenada y representa a concentração do analito no estágio correspondente da titulação (em um titulação ácido-base, a coordenada y geralmente representa o pH da solução).
Em uma titulação ácido - base , a curva de titulação representa a força do ácido e da base correspondentes. Para um ácido forte e uma base forte, a curva será relativamente lisa e muito íngreme perto do ponto de equivalência. Por causa disso, uma pequena mudança no volume do titulante perto do ponto de equivalência resulta em uma grande mudança de pH e muitos indicadores seriam apropriados (por exemplo , tornassol , fenolftaleína ou azul de bromotimol ).
Se um reagente é um ácido ou base fraco e o outro é um ácido ou base forte, a curva de titulação é irregular e o pH muda menos com pequenas adições de titulante perto do ponto de equivalência . Por exemplo, a curva de titulação para a titulação entre ácido oxálico (um ácido fraco) e hidróxido de sódio (uma base forte) é mostrada. O ponto de equivalência ocorre entre pH 8-10, indicando que a solução é básica no ponto de equivalência e um indicador como fenolftaleína seria apropriado. As curvas de titulação correspondentes a bases fracas e ácidos fortes têm comportamento semelhante, sendo a solução ácida no ponto de equivalência e indicadores como laranja de metila e azul de bromotimol sendo os mais apropriados.
As titulações entre um ácido fraco e uma base fraca têm curvas de titulação muito irregulares. Por causa disso, nenhum indicador definitivo pode ser apropriado e um medidor de pH é freqüentemente usado para monitorar a reação.
O tipo de função que pode ser usado para descrever a curva é denominado função sigmóide .
Tipos de titulações
Existem muitos tipos de titulações com diferentes procedimentos e objetivos. Os tipos mais comuns de titulação qualitativa são titulações ácido-base e titulações redox .
Titulação ácido-base
| Indicador | Cor no lado ácido | Faixa de mudança de cor (pH) |
Cor no lado básico |
|---|---|---|---|
| Violeta de metila | Amarelo | 0,0-1,6 | Tolet |
| Azul de bromofenol | Amarelo | 3,0-4,6 | Azul |
| Laranja de metila | vermelho | 3,1-4,4 | Amarelo |
| Vermelho de metila | vermelho | 4,4-6,3 | Amarelo |
| Litmus | vermelho | 5,0–8,0 | Azul |
| Azul de bromotimol | Amarelo | 6,0-7,6 | Azul |
| Fenolftaleína | Incolor | 8,3-10,0 | Cor de rosa |
| Alizarin amarelo | Amarelo | 10,1-12,0 | vermelho |
As titulações ácido-base dependem da neutralização entre um ácido e uma base quando misturados em solução. Além da amostra, um indicador de pH apropriado é adicionado à câmara de titulação, representando a faixa de pH do ponto de equivalência. O indicador ácido-base indica o ponto final da titulação mudando a cor. O ponto final e o ponto de equivalência não são exatamente os mesmos porque o ponto de equivalência é determinado pela estequiometria da reação, enquanto o ponto final é apenas a mudança de cor do indicador. Assim, uma seleção cuidadosa do indicador reduzirá o erro do indicador. Por exemplo, se o ponto de equivalência está em um pH de 8,4, então o indicador de fenolftaleína seria usado em vez do Amarelo de Alizarina porque a fenolftaleína reduziria o erro do indicador. Os indicadores comuns, suas cores e a faixa de pH em que mudam de cor são fornecidos na tabela acima. Quando resultados mais precisos são necessários, ou quando os reagentes são um ácido fraco e uma base fraca, um medidor de pH ou um medidor de condutância são usados.
Para bases muito fortes, como reagente de organolítio , amidas de metal e hidretos , a água geralmente não é um solvente adequado e os indicadores cujo pKa estão na faixa de variações de pH aquoso são de pouca utilidade. Em vez disso, o titulante e o indicador usados são ácidos muito mais fracos e são usados solventes anidros como o THF .
O pH aproximado durante a titulação pode ser aproximado por três tipos de cálculos. Antes de iniciar a titulação, a concentração de é calculada em solução aquosa de ácido fraco antes de adicionar qualquer base. Quando o número de moles de bases adicionadas é igual ao número de moles de ácido inicial ou o chamado ponto de equivalência , um de hidrólise e o pH são calculados da mesma forma que as bases conjugadas do ácido titulado foram calculadas. Entre os pontos inicial e final, é obtido a partir da equação de Henderson-Hasselbalch e a mistura de titulação é considerada como tampão. Na equação de Henderson-Hasselbalch, o [ácido] e a [base] são considerados as molaridades que estariam presentes mesmo com a dissociação ou hidrólise. Em um tampão, pode ser calculado com exatidão, mas a dissociação do HA , a hidrólise e a autoionização da água devem ser levadas em consideração. Quatro equações independentes devem ser usadas:
Nas equações, e são os moles de ácido ( HA ) e sal ( XA em que X é o catião), respectivamente, utilizado no tampão, e o volume da solução é V . A lei da ação da massa é aplicada à ionização da água e à dissociação do ácido para derivar a primeira e a segunda equações. O balanço de massa é usado na terceira equação, onde a soma de e deve ser igual ao número de moles de ácido e base dissolvidos, respectivamente. O equilíbrio de carga é usado na quarta equação, onde o lado esquerdo representa a carga total dos cátions e o lado direito representa a carga total dos ânions: é a molaridade do cátion (por exemplo, sódio, se sal de sódio do ácido ou hidróxido de sódio é usado para fazer o tampão).
Titulação redox
As titulações redox são baseadas em uma reação de redução-oxidação entre um agente oxidante e um agente redutor. Um potenciômetro ou indicador redox é normalmente usado para determinar o ponto final da titulação, como quando um dos constituintes é o agente oxidante dicromato de potássio . A mudança de cor da solução de laranja para verde não é definitiva, portanto, um indicador como a difenilamina de sódio é usado. A análise de vinhos quanto ao dióxido de enxofre requer iodo como agente oxidante. Nesse caso, o amido é usado como indicador; um complexo amido-iodo azul é formado na presença de excesso de iodo, sinalizando o ponto final.
Algumas titulações redox não requerem indicador, devido à cor intensa dos constituintes. Por exemplo, na permanganometria, uma leve persistência de cor rosa sinaliza o ponto final da titulação por causa da cor do excesso de permanganato de potássio do agente oxidante . Na iodometria , em concentrações suficientemente grandes, o desaparecimento do íon triiodeto vermelho-marrom profundo pode ser usado como um ponto final, embora em concentrações mais baixas a sensibilidade seja melhorada pela adição do indicador de amido , que forma um complexo intensamente azul com triiodeto.

Titulação da fase gasosa
Titulações em fase gasosa são titulações feitas na fase gasosa , especificamente como métodos para determinar espécies reativas por reação com um excesso de algum outro gás, agindo como titulante. Em uma titulação de fase gasosa comum, o ozônio gasoso é titulado com óxido de nitrogênio de acordo com a reação
- O 3 + NO → O 2 + NO 2 .
Após a conclusão da reação, o titulante e o produto restantes são quantificados (por exemplo, por espectroscopia de transformada de Fourier ) (FT-IR); isso é usado para determinar a quantidade de analito na amostra original.
A titulação da fase gasosa tem várias vantagens sobre a espectrofotometria simples . Primeiro, a medição não depende do comprimento do caminho, porque o mesmo comprimento do caminho é usado para a medição do titulante em excesso e do produto. Em segundo lugar, a medição não depende de uma mudança linear na absorbância em função da concentração do analito, conforme definido pela lei de Beer-Lambert . Terceiro, é útil para amostras contendo espécies que interferem em comprimentos de onda tipicamente usados para o analito.
Titulação complexométrica
Titulações complexométricas dependem da formação de um complexo entre o analito e o titulante. Em geral, eles requerem indicadores complexométricos especializados que formam complexos fracos com o analito. O exemplo mais comum é o uso de indicador de amido para aumentar a sensibilidade da titulação iodométrica, o complexo azul escuro do amido com iodo e iodo sendo mais visível do que o iodo sozinho. Outros indicadores complexométricos são Eriochrome Black T para a titulação de íons de cálcio e magnésio e o agente quelante EDTA usado para titular íons de metal em solução.
Titulação de potencial zeta
As titulações de potencial zeta são titulações em que a conclusão é monitorada pelo potencial zeta , em vez de por um indicador , a fim de caracterizar sistemas heterogêneos , como os colóides . Um dos usos é determinar o ponto isoelétrico quando a carga superficial chega a zero, obtido pela alteração do pH ou adição de surfactante . Outro uso é determinar a dose ótima para floculação ou estabilização .
Ensaio
Um ensaio é um tipo de titulação biológica usado para determinar a concentração de um vírus ou bactéria . Diluições em série são realizadas em uma amostra em uma proporção fixa (como 1: 1, 1: 2, 1: 4, 1: 8, etc.) até que a última diluição não dê um teste positivo para a presença do vírus. O valor positivo ou negativo pode ser determinado inspecionando as células infectadas visualmente sob um microscópio ou por um método imunoenzimétrico, como o ensaio de imunoabsorção enzimática (ELISA). Este valor é conhecido como título .
Medindo o ponto final de uma titulação
Métodos diferentes para determinar o ponto final incluem:
- Indicador: uma substância que muda de cor em resposta a uma mudança química. Um indicador ácido-base (por exemplo, fenolftaleína ) muda de cor dependendo do pH. Indicadores Redox também são usados. Uma gota da solução indicadora é adicionada à titulação no início; o ponto final foi alcançado quando a cor muda.
- Potenciômetro : Instrumento que mede o potencial do eletrodo da solução. Eles são usados para titulações redox; o potencial do eletrodo de trabalho mudará repentinamente quando o ponto final for atingido.

- Medidor de pH : Potenciômetro com eletrodo cujo potencial depende da quantidade de íon H + presente na solução. (Este é um exemplo de um eletrodo seletivo de íons .) O pH da solução é medido ao longo da titulação, com mais precisão do que com um indicador; no ponto final, haverá uma mudança repentina no pH medido.
- Condutividade : Uma medida de íons em uma solução. A concentração de íons pode mudar significativamente em uma titulação, o que altera a condutividade. (Por exemplo, durante uma titulação ácido-base, os íons H + e OH - reagem para formar H 2 O neutro ). Como a condutância total depende de todos os íons presentes na solução e nem todos os íons contribuem igualmente (devido à mobilidade e iônica força ), prever a mudança na condutividade é mais difícil do que medi-la.
- Mudança de cor: em algumas reações, a solução muda de cor sem qualquer indicador adicionado. Isso é freqüentemente visto em titulações redox, quando os diferentes estados de oxidação do produto e reagente produzem cores diferentes.
- Precipitação : Se uma reação produzir um sólido, um precipitado se formará durante a titulação. Um exemplo clássico é a reação entre Ag + e Cl - para formar o sal insolúvel AgCl. Precipitados nublados geralmente tornam difícil determinar o ponto final com precisão. Para compensar, as titulações de precipitação freqüentemente têm que ser feitas como titulações "reversas" (veja abaixo).
- Calorímetro de titulação isotérmica : Um instrumento que mede o calor produzido ou consumido pela reação para determinar o ponto final. Usado em titulações bioquímicas , como a determinação de como os substratos se ligam às enzimas .
- Titrimetria termométrica : Diferenciada da titulação calorimétrica porque o calor da reação (conforme indicado pelo aumento ou queda da temperatura) não é usado para determinar a quantidade de analito na solução da amostra. Em vez disso, o ponto final é determinado pela taxa de mudança de temperatura .
- Espectroscopia : Usada para medir a absorção de luz pela solução durante a titulação se o espectro do reagente, titulante ou produto for conhecido. A concentração do material pode ser determinada pela Lei de Beer .
- Amperometria : Mede a corrente produzida pela reação de titulação como resultado da oxidação ou redução do analito. O ponto final é detectado como uma mudança na corrente. Este método é mais útil quando o excesso de titulante pode ser reduzido, como na titulação de haletos com Ag + .
Ponto final e ponto de equivalência
Embora os termos ponto de equivalência e ponto final sejam freqüentemente usados de forma intercambiável, eles são termos diferentes. O ponto de equivalência é a conclusão teórica da reação: o volume de titulante adicionado em que o número de moles de titulante é igual ao número de moles de analito, ou algum múltiplo dele (como em ácidos polipróticos ). Ponto final é o que realmente é medido, uma mudança física na solução conforme determinado por um indicador ou instrumento mencionado acima.
Há uma ligeira diferença entre o ponto final e o ponto de equivalência da titulação. Esse erro é conhecido como erro de indicador e é indeterminado.
Titulação traseira
A titulação reversa é uma titulação feita ao contrário; em vez de titular a amostra original, um excesso conhecido de reagente padrão é adicionado à solução e o excesso é titulado. Uma titulação reversa é útil se o ponto final da titulação reversa for mais fácil de identificar do que o ponto final da titulação normal, como acontece com as reações de precipitação . As titulações reversas também são úteis se a reação entre o analito e o titulante for muito lenta ou quando o analito estiver em um sólido insolúvel .
Métodos gráficos
O processo de titulação cria soluções com composições que variam de ácido puro a base pura. Identificar o pH associado a qualquer estágio do processo de titulação é relativamente simples para ácidos e bases monopróticos. A presença de mais de um grupo de ácido ou base complica esses cálculos. Métodos gráficos, como o equilígrafo, há muito tempo são usados para explicar a interação de equilíbrios acoplados. Esses métodos de solução gráfica são simples de implementar, mas raramente são usados.
Usos particulares
Titulações ácido-base
- Para combustível biodiesel : óleo vegetal residual (WVO) deve ser neutralizado antes que um lote possa ser processado. Uma parte do WVO é titulada com uma base para determinar a acidez, para que o resto do lote possa ser neutralizado de maneira adequada. Isso remove os ácidos graxos livres da WVO que normalmente reagiriam para fazer sabão em vez de combustível biodiesel.
- Método Kjeldahl : uma medida do teor de nitrogênio em uma amostra. O nitrogênio orgânico é digerido em amônia com ácido sulfúrico e sulfato de potássio . Finalmente, a amônia é titulada de volta com ácido bórico e carbonato de sódio .
- Valor de ácido : a massa em miligramas de hidróxido de potássio (KOH) necessária para titular totalmente um ácido em um grama de amostra. Um exemplo é a determinação do teor de ácidos graxos livres .
- Valor de saponificação : a massa em miligramas de KOH necessária para saponificar um ácido graxo em um grama de amostra. A saponificação é usada para determinar o comprimento médio da cadeia de ácidos graxos na gordura.
- Valor do éster (ou índice do éster): um índice calculado. Valor éster = valor de saponificação - valor ácido.
- Valor de amina: a massa em miligramas de KOH igual ao teor de amina em um grama de amostra.
- Valor de hidroxila : a massa em miligramas de KOH correspondente a grupos hidroxila em um grama de amostra. O analito é acetilado usando anidrido acético e então titulado com KOH.
Titulações redox
- Teste de Winkler para oxigênio dissolvido : usado para determinar a concentração de oxigênio na água. O oxigênio em amostras de água é reduzido usando sulfato de manganês (II) , que reage com o iodeto de potássio para produzir iodo . O iodo é liberado na proporção do oxigênio na amostra, portanto, a concentração de oxigênio é determinada com uma titulação redox de iodo com tiossulfato usando um indicador de amido.
- Vitamina C : também conhecida como ácido ascórbico, a vitamina C é um poderoso agente redutor. Sua concentração pode ser facilmente identificada quando titulada com o corante azul Diclorofenolindofenol ( DCPIP ) que se torna incolor quando reduzido pela vitamina.
- Reagente de Benedict : O excesso de glicose na urina pode indicar diabetes em um paciente. O método de Benedict é o método convencional para quantificar a glicose na urina usando um reagente preparado. Durante esse tipo de titulação, a glicose reduz os íons cúpricos a íons cuprosos que reagem com o tiocianato de potássio para produzir um precipitado branco, indicando o ponto final.
- Número de bromo : uma medida de insaturação em um analito, expresso em miligramas de bromo absorvido por 100 gramas de amostra.
- Número de iodo : uma medida de insaturação em um analito, expresso em gramas de iodo absorvido por 100 gramas de amostra.
Diversos
- Titulação Karl Fischer : Um método potenciométrico para analisar traços de água em uma substância. Uma amostra é dissolvida em metanol e titulada com reagente Karl Fischer. O reagente contém iodo, que reage proporcionalmente com a água. Assim, o teor de água pode ser determinado monitorando o potencial elétrico do excesso de iodo.
Veja também
- Os padrões primários são compostos com propriedades consistentes e confiáveis usados para preparar soluções padrão para titulações.
Referências
links externos
- Wikihow: Executar uma titulação
- Um guia interativo para titulação
- Science Aid: Uma explicação simples de titulações, incluindo exemplos de cálculo
- Freeware de titulação - simulação de qualquer curva de pH vs. volume, diagramas de distribuição e análise de dados reais
- Método gráfico para resolver problemas de ácido-base, incluindo titulações
- Solucionador gráfico e numérico para problemas gerais de ácido-base - Programa de software para telefones e tablets





![{\ displaystyle {\ ce {[H +]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2f6781ee107d64f14c7da0bb7d25c3a8e3c4235f)

![{\ displaystyle [{\ ce {H +}}] [{\ ce {OH -}}] = 10 ^ {- 14}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e64e80f918a64e1000aa161c7f047b046ed20149)
![{\ displaystyle [{\ ce {H +}}] = K_ {a} {\ ce {{\ frac {[HA]} {[A ^ {-}]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9d401c8135577b043dbcb08c4ebc4b3340ce8430)
![{\ displaystyle [{\ ce {HA}}] + [{\ ce {A -}}] = {\ frac {(n _ {{\ ce {A}}} + n _ {{\ ce {B}}} )} {V}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1515a6091588b1b119a198b28d6d1908decca748)
![{\ displaystyle [{\ ce {H +}}] + {\ frac {n _ {{\ ce {B}}}} {V}} = [{\ ce {A -}}] + [{\ ce {OH -}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/60c7344bbd50c9a75dcb598142e874aa39349a93)


![{\ displaystyle V [{\ ce {HA}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b2580ec25274d91056971bfecc5c37718436f9c1)
![{\ displaystyle V [{\ ce {A-}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/45100d92fd8e282f61ee30e05034cbe2853523dd)

