Transesterificação - Transesterification
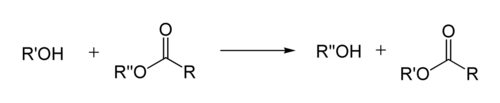
Em química orgânica , a transesterificação é o processo de troca do grupo orgânico R ″ de um éster pelo grupo orgânico R ′ de um álcool . Essas reações são frequentemente catalisadas pela adição de um catalisador ácido ou básico . A reação também pode ser realizada com a ajuda de outras enzimas, particularmente lipases (um exemplo é a lipase EC3.1.1.3).
Ácidos fortes catalisam a reação doando um próton ao grupo carbonila , tornando-o um eletrófilo mais potente , enquanto as bases catalisam a reação removendo um próton do álcool, tornando-o mais nucleofílico . Os ésteres com grupos alcoxi maiores podem ser feitos de ésteres metílicos ou etílicos em alta pureza, aquecendo a mistura de éster, ácido / base e álcool grande e evaporando o álcool pequeno para direcionar o equilíbrio.
Mecanismo
No mecanismo de transesterificação, o carbono carbonílico do éster de partida reage para dar um intermediário tetraédrico, que ou reverte para o material de partida, ou prossegue para o produto transesterificado (RCOOR 2 ). As várias espécies existem em equilíbrio e a distribuição do produto depende das energias relativas do reagente e do produto.
Formulários
Produção de poliéster
A aplicação de transesterificação em maior escala é na síntese de poliésteres . Nesta aplicação, os diésteres sofrem transesterificação com dióis para formar macromoléculas. Por exemplo, tereftalato de dimetila e etilenoglicol reagem para formar tereftalato de polietileno e metanol , que é evaporado para levar a reação adiante.
Metanólise e produção de biodiesel
A reação reversa, metanólise, também é um exemplo de transesterificação. Este processo tem sido usado para reciclar poliésteres em monômeros individuais (veja reciclagem de plástico ). Ele também é usado para converter gorduras ( triglicerídeos ) em biodiesel . Essa conversão foi um dos primeiros usos. Óleo vegetal transesterificado ( biodiesel ) foi usado para fornecer energia a veículos pesados na África do Sul antes da Segunda Guerra Mundial .
Foi patenteado nos Estados Unidos na década de 1950 pela Colgate , embora a transesterificação de biolipídios possa ter sido descoberta muito antes. Na década de 1940, os pesquisadores estavam procurando um método para produzir glicerol mais prontamente , que foi usado para produzir explosivos para a Segunda Guerra Mundial. Muitos dos métodos usados hoje pelos produtores têm sua origem na pesquisa original dos anos 1940.
A transesterificação de biolipídios também foi recentemente demonstrada por pesquisadores japoneses como sendo possível usando uma metodologia de metanol supercrítica, em que vasos de alta temperatura e alta pressão são usados para catalisar fisicamente a reação biolipídio / metanol em ésteres metílicos de ácidos graxos.
Processamento de gordura
A interesterificação de gordura é usada na indústria de alimentos para reorganizar os ácidos graxos dos triglicerídeos em gorduras comestíveis e óleos vegetais . Por exemplo, uma gordura sólida com ácidos graxos principalmente saturados pode ser transesterificada com um óleo vegetal com alto teor de ácidos insaturados, para produzir uma gordura semissólida que pode ser espalhada cujas moléculas têm uma mistura de ambos os tipos de ácidos.
Síntese
A transesterificação é usada para sintetizar derivados de enol , que são difíceis de preparar por outros meios. O acetato de vinila, que é barato, passa por transesterificação, dando acesso aos éteres de vinila :
-
ROH + AcOCH = CH
2⟶ ROCH = CH
2+ AcOH
Veja também
Referências
- ^ Otera, Junzo. (Junho de 1993). “Transesterificação”. Revisões químicas . 93 (4): 1449–1470. doi : 10.1021 / cr00020a004 .
- ^ "ENZIMA - 3.1.1.3 Triacilglicerol lipase" . enzima.expasy.org . SIB Swiss Institute of Bioinformatics . Página visitada em 17 de fevereiro de 2021 .
- ^ Wilhelm Riemenschneider1 e Hermann M. Bolt "Esters, Organic" Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim. doi : 10.1002 / 14356007.a09_565.pub2
- ^ Tomotaka Hirabayashi, Satoshi Sakaguchi, Yasutaka Ishii (2005). "Síntese catalisada por irídio de éteres de vinila a partir de álcoois e acetato de vinila" . Org. Synth . 82 : 55. doi : 10.15227 / orgsyn.082.0055 .CS1 maint: usa o parâmetro de autores ( link )
- ^ Yasushi Obora, Yasutaka Ishii (2012). "Adendo para discussão: Síntese catalisada por irídio de éteres de vinila a partir de álcoois e acetato de vinila". Org. Synth . 89 : 307. doi : 10.15227 / orgsyn.089.0307 .CS1 maint: usa o parâmetro de autores ( link )