Reação de Tsuji-Trost - Tsuji–Trost reaction
A reacção Tsuji-Trost (também chamada a alquilação alílica Trost ou a alquilação ali liça ) é uma paládio - catalisada reacção de substituição envolvendo um substrato que contém um grupo que se despede em um alílico posição. O catalisador de paládio primeiro se coordena com o grupo alil e então sofre adição oxidativa , formando o complexo π- alil. Este complexo de alila pode então ser atacado por um nucleófilo , resultando no produto substituído.
Este trabalho foi iniciado pela primeira vez por Jirō Tsuji em 1965 e, posteriormente, adaptado por Barry Trost em 1973 com a introdução de ligantes fosfina . O escopo desta reação foi expandido para muitos nucleófilos baseados em carbono, nitrogênio e oxigênio diferentes, muitos grupos de saída diferentes, muitos ligantes baseados em fósforo, nitrogênio e enxofre diferentes e muitos metais diferentes (embora o paládio ainda seja preferido). A introdução de ligantes de fosfina levou a uma reatividade melhorada e a várias estratégias de alquilação alílica assimétrica. Muitas dessas estratégias são impulsionadas pelo advento de ligantes quirais , que muitas vezes são capazes de fornecer alta enantiosseletividade e alta diastereosseletividade em condições moderadas. Esta modificação expande muito a utilidade desta reação para muitas aplicações sintéticas diferentes. A capacidade de formar ligações carbono-carbono, carbono-nitrogênio e carbono-oxigênio nessas condições torna essa reação muito atraente para os campos da química medicinal e da síntese de produtos naturais.
História
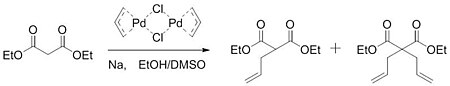
Em 1962, Smidt publicou um trabalho sobre a oxidação catalisada por paládio de alquenos em grupos carbonil . Neste trabalho, foi determinado que o catalisador de paládio ativou o alceno para o ataque nucleofílico do hidróxido . Obtendo uma visão deste trabalho, Tsuji levantou a hipótese de que uma ativação semelhante poderia ocorrer para formar ligações carbono-carbono. Em 1965, Tsuji relatou um trabalho que confirmou sua hipótese. Ao reagir um dímero de cloreto de alilpaládio com o sal de sódio de malonato de dietila , o grupo foi capaz de formar uma mistura de produto monoalquilado e dialquilado .
O escopo da reação foi expandido apenas gradualmente até que Trost descobriu o próximo grande avanço em 1973. Enquanto tentava sintetizar homólogos de sesquiterpeno acíclicos, Trost teve problemas com o procedimento inicial e não foi capaz de alquilar seus substratos. Esses problemas foram superados com a adição de trifenilfosfina à mistura de reação.
Essas condições foram então testadas para outros substratos e algumas levaram a uma "reação essencialmente instantânea à temperatura ambiente". Logo depois, ele desenvolveu uma maneira de usar esses ligantes para síntese assimétrica. Não surpreendentemente, isso estimulou muitas outras investigações dessa reação e levou ao importante papel que essa reação agora desempenha na química sintética.
Mecanismo
Começando com uma espécie de paládio zerovalente e um substrato contendo um grupo abandonante na posição alílica, a reação de Tsuji-Trost prossegue através do ciclo catalítico descrito abaixo.
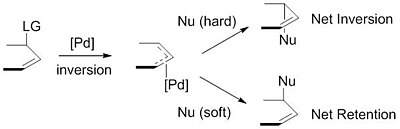
Primeiro, o paládio se coordena com o alceno, formando um complexo η2 π -alil- Pd0 Π . O próximo passo é adição oxidativa na qual o grupo de saída é expelido com inversão de configuração e um η3 ¸ -alil- PDII é criado (também chamado de ionização). O nucleófilo então adiciona ao grupo alil regenerando o complexo η2 π -alil-Pd0. Na conclusão da reação, o paládio se desprende do alceno e pode iniciar novamente no ciclo catalítico .
Nucleófilos "duros" versus "suaves"
Os nucleófilos usados são tipicamente gerados a partir de precursores (pronucleófilos) in situ após sua desprotonação com base. Esses nucleófilos são então subdivididos em nucleófilos "duros" e "moles" usando um paradigma para descrever nucleófilos que se baseia amplamente no pKas de seus ácidos conjugados . Os nucleófilos "duros" normalmente têm ácidos conjugados com pKas maiores que 25, enquanto os nucleófilos "macios" normalmente têm ácidos conjugados com pKas menores que 25. Este descritor é importante devido ao impacto que esses nucleófilos têm na estereosseletividade do produto. Os nucleófilos estabilizados ou "suaves" invertem a estereoquímica do complexo π- alil. Esta inversão em conjunto com a inversão na estereoquímica associada à adição oxidativa de paládio produz uma retenção líquida da estereoquímica. Os nucleófilos não estabilizados ou "duros", por outro lado, retêm a estereoquímica do complexo π- alil, resultando em uma inversão líquida da estereoquímica.
Essa tendência é explicada pelo exame dos mecanismos de ataque nucleofílico. Os nucleófilos "macios" atacam o carbono do grupo alil, enquanto os nucleófilos "duros" atacam o centro do metal, seguido pela eliminação redutiva.
Ligantes de fosfina
Ligantes de fosfina, como trifenilfosfina ou o ligante Trost , têm sido usados para expandir muito o escopo da reação Tsuji-Trost. Esses ligantes podem modular as propriedades do catalisador de paládio, como massa estérica , bem como as propriedades eletrônicas. É importante ressaltar que esses ligantes também podem instilar quiralidade ao produto final, tornando possível que essas reações sejam realizadas de forma assimétrica, conforme mostrado abaixo.
Substituição assimétrica alílica
A versão enantiosseletiva da reação de Tsuji-Trost é chamada de alquilação alílica assimétrica Trost (Trost AAA) ou simplesmente alquilação alílica assimétrica (AAA). Essas reações são frequentemente utilizadas em síntese assimétrica. A reação foi originalmente desenvolvida com um catalisador de paládio suportado pelo ligante Trost , embora as condições adequadas tenham se expandido muito desde então. A enantiosseletividade pode ser conferida à reação durante qualquer uma das etapas além da descomplexação do paládio do alceno, uma vez que o estereocentro já está estabelecido nesse ponto. Cinco formas principais foram conceituadas para tirar vantagem dessas etapas e produzir condições de reação enantiosseletiva. Esses métodos de enantiodiscriminação foram revisados anteriormente por Trost:
- Ionização preferencial via complexação de olefina enantiosseletiva
- Ionização enantiotópica de grupos de saída
- Ataque a Termini Enantiotópico do Complexo Allyl
- Troca de enantioface no complexo π- Allyl
- Diferenciação de faces nucleófilas pró-quirais
O método preferido para enantiodiscriminação é amplamente dependente do substrato de interesse e, em alguns casos, a enantioseletividade pode ser influenciada por vários desses fatores.
Alcance
Nucleófilos
Muitos nucleófilos diferentes foram relatados como eficazes para esta reação. Alguns dos nucleófilos mais comuns incluem malonatos , enolatos , alcóxidos primários , carboxilatos , fenóxidos , aminas , azidas , sulfonamidas , imidas e sulfonas .
Saindo dos grupos
O escopo dos grupos de saída também foi expandido para incluir vários grupos de saída diferentes, embora carbonatos , fenóis , fosfatos , halogenetos e carboxilatos sejam os mais amplamente usados.
Nucleófilos "duros" e "suaves"
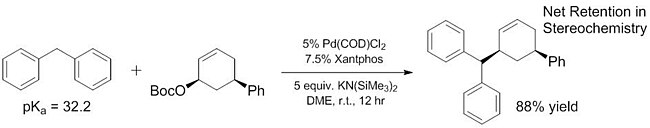
Um trabalho recente demonstrou que o escopo de nucleófilos "suaves" pode ser expandido para incluir alguns pronucleófilos que têm pKas muito mais altos do que ~ 25. Alguns desses nucleófilos "suaves" têm pKas variando até 32, e ainda mais pronucleófilos básicos ( ~ 44) mostraram agir como nucleófilos moles com a adição de ácidos de Lewis que ajudam a facilitar a desprotonação. A gama de pKa melhorada de nucleófilos "suaves" é crítica porque esses nucleófilos são os únicos que foram explorados para reações enantiosseletivas até muito recentemente (embora as reações não enantiosseletivas de nucleófilos "duros" sejam conhecidas há algum tempo). Ao aumentar o escopo de pronucleófilos que atuam como nucleófilos "suaves", esses substratos também podem ser incorporados em reações enantiosseletivas usando métodos previamente relatados e bem caracterizados.
Ligantes
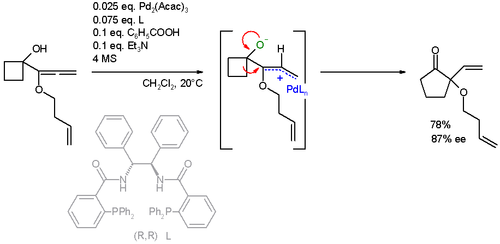
Com base na reatividade do ligante trifenilfosfina, a estrutura dos ligantes usados para a reação Tsuji-Trost rapidamente se tornou mais complexa. Hoje, esses ligantes podem conter fósforo, enxofre, nitrogênio ou alguma combinação desses elementos, mas a maioria dos estudos tem se concentrado nos ligantes mono e difosfina. Esses ligantes podem ser classificados com base na natureza de sua quiralidade, com alguns ligantes contendo quiralidade central no fósforo ou átomos de carbono, alguns contendo quiralidade biaril axial e outros contendo quiralidade plana . Ligantes difosfina com quiralidade central emergiram como um tipo eficaz de ligante (particularmente para procedimentos de alquilação alílico assimétricos) com o Ligante Trost sendo um exemplo. Ligantes de fosfinooxazolinas (PHOX) têm sido empregados no AAA, particularmente com nucleófilos à base de carbono.
Substratos adicionais
O substrato da reação também foi estendido a alenos . Nesta expansão de anel específica, a reação AAA também é acompanhada por um rearranjo de Wagner-Meerwein :
Formulários
Síntese de produtos farmacêuticos / naturais
A capacidade de formar ligações carbono-carbono, carbono-nitrogênio e carbono-oxigênio enantiosseletivamente sob condições suaves torna a alquilação alílica assimétrica Trost extremamente atraente para a síntese de moléculas complexas.
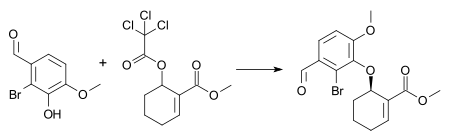
Um exemplo dessa reação é a síntese de um intermediário na síntese total combinada de galantamina e morfina com 1 mol% [dímero de cloreto de pi-alilpaládio], 3 mol% ( S, S ) de ligante Trost e trietilamina em diclorometano à temperatura ambiente . Essas condições resultam na formação do (-) - enantiômero do éter arílico com 72% de rendimento químico e 88% de excesso enantiomérico .
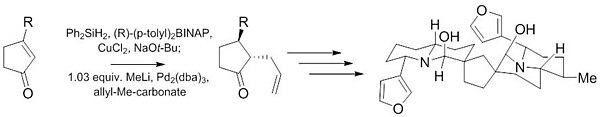
Outra reação de Tsuji-Trost foi usada durante os estágios iniciais da síntese de (-) - Neotiobinupharidina. Este trabalho recente demonstra a capacidade desta reação para fornecer produtos altamente diastereosseletivos (10: 1) e enantiosseletivos (97,5: 2,5) de material de partida aquiral com apenas uma pequena quantidade de catalisador ( 1% ).
Detecção de paládio
Além da aplicação prática dessa reação na química medicinal e na síntese de produtos naturais, um trabalho recente também usou a reação de Tsuji-Trost para detectar o paládio em vários sistemas. Este sistema de detecção é baseado em um sensor não fluorescente derivado de fluorescência (sensores de comprimento de onda mais longo também foram desenvolvidos recentemente para outras aplicações) que se torna fluorescente apenas na presença de paládio ou platina. Essa capacidade de detecção de paládio / platina é impulsionada pela reação Tsuji-Trost. O sensor contém um grupo alil com a fluoresceína funcionando como o grupo de saída. O complexo π- alil é formado e, após um ataque do nucleófilo, a fluoresceína é liberada, produzindo um aumento dramático na fluorescência.
Este método simples e de alto rendimento para detectar paládio monitorando a fluorescência demonstrou ser útil no monitoramento dos níveis de paládio em minérios metálicos , produtos farmacêuticos e até mesmo em células vivas . Com a popularidade cada vez maior da catálise de paládio , este tipo de detecção rápida deve ser muito útil para reduzir a contaminação de produtos farmacêuticos e prevenir a poluição do meio ambiente com paládio e platina.
Referências
links externos
- Org. Synth. 1989, 67, 105
- Org. Synth. 2009, 86, 47
- exemplo de reação tsuji-trost em síntese total ver: http://www.biocis.u-psud.fr/IMG/pdf/concise_total_synthesis_of_Minfiensine.pdf a segunda reação encontrada no site da equipe biocis: http: //www.biocis .u-psud.fr / spip.php? article332