Unbibium - Unbibium
| Unbibium | ||||||
|---|---|---|---|---|---|---|
| Pronúncia |
/ ˌ u n b aɪ b aɪ ə m / ( OON -by- POR -əm ) |
|||||
| Nomes alternativos | elemento 122, eka-thorium | |||||
| Unbibium na tabela periódica | ||||||
| ||||||
| Número atômico ( Z ) | 122 | |||||
| Grupo | grupo n / a | |||||
| Período | período 8 | |||||
| Bloquear | bloco g | |||||
| Configuração de elétron | as previsões variam, veja o texto | |||||
| Propriedades físicas | ||||||
| desconhecido | ||||||
| Fase em STP | desconhecido | |||||
| Propriedades atômicas | ||||||
| Estados de oxidação | ( +4 ) (previsto) | |||||
| Energias de ionização | ||||||
| Outras propriedades | ||||||
| Número CAS | 54576-73-7 | |||||
| História | ||||||
| Nomeação | Nome do elemento sistemático IUPAC | |||||
Unbibium , também conhecido como elemento 122 ou eka-thorium , é o elemento químico hipotético na tabela periódica com o símbolo de espaço reservado de Ubb e número atômico 122. Unbibium e Ubb são o nome e símbolo sistemático temporário IUPAC respectivamente, que são usados até o elemento é descoberto, confirmado e um nome permanente é decidido. Na tabela periódica dos elementos, espera-se que siga o unbiunium como o segundo elemento dos superactinídeos e o quarto elemento do 8º período . Da mesma forma que o unbiunium, espera-se que caia dentro da faixa da ilha de estabilidade , potencialmente conferindo estabilidade adicional a alguns isótopos, especialmente 306 Ubb, que se espera que tenha um número mágico de nêutrons (184).
Apesar de várias tentativas, o unbibium ainda não foi sintetizado, nem foi encontrado nenhum isótopo de ocorrência natural. Atualmente não há planos para tentar sintetizar o antibiótico. Em 2008, alegou-se que foi descoberto em amostras de tório natural, mas essa alegação foi rejeitada por repetições recentes do experimento usando técnicas mais precisas.
Quimicamente, o antibiótico deve mostrar alguma semelhança com o cério e o tório . No entanto, os efeitos relativísticos podem fazer com que algumas de suas propriedades sejam diferentes; por exemplo, espera-se que tenha uma configuração de elétron do estado fundamental de [ Og ] 7d 1 8s 2 8p 1 ou [Og] 8s 2 8p 2 , apesar de sua posição prevista na série de superactinídeos do bloco g.
Introdução

| Vídeo externo | |
|---|---|
|
|
Os núcleos atômicos mais pesados são criados em reações nucleares que combinam dois outros núcleos de tamanhos desiguais em um; grosso modo, quanto mais desiguais os dois núcleos em termos de massa, maior a possibilidade de os dois reagirem. O material formado pelos núcleos mais pesados é transformado em alvo, que é então bombardeado pelo feixe de núcleos mais leves. Dois núcleos só podem se fundir em um se se aproximarem um do outro; normalmente, os núcleos (todos carregados positivamente) se repelem devido à repulsão eletrostática . A interação forte pode superar essa repulsão, mas apenas dentro de uma distância muito curta de um núcleo; os núcleos do feixe são, portanto, grandemente acelerados a fim de tornar essa repulsão insignificante em comparação com a velocidade do núcleo do feixe. Chegar perto sozinho não é suficiente para dois núcleos se fundirem: quando dois núcleos se aproximam, eles geralmente permanecem juntos por aproximadamente 10-20 segundos e então se separam (não necessariamente na mesma composição de antes da reação) em vez de formar um único núcleo. Se a fusão ocorrer, a fusão temporária - denominada núcleo composto - é um estado excitado . Para perder sua energia de excitação e atingir um estado mais estável, um núcleo composto fissiona ou ejeta um ou vários nêutrons , que carregam a energia. Isso ocorre em aproximadamente 10 a 16 segundos após a colisão inicial.
O feixe passa pelo alvo e atinge a próxima câmara, o separador; se um novo núcleo é produzido, ele é carregado com este feixe. No separador, o núcleo recém-produzido é separado de outros nuclídeos (o do feixe original e quaisquer outros produtos de reação) e transferido para um detector de barreira de superfície , que pára o núcleo. A localização exata do próximo impacto no detector é marcada; também marcados são sua energia e o tempo da chegada. A transferência leva cerca de 10 −6 segundos; para ser detectado, o núcleo deve sobreviver por tanto tempo. O núcleo é registrado novamente assim que sua decadência é registrada, e a localização, a energia e o tempo de decadência são medidos.
A estabilidade de um núcleo é fornecida pela interação forte. No entanto, seu alcance é muito curto; à medida que os núcleos se tornam maiores, sua influência sobre os núcleos mais externos ( prótons e nêutrons) enfraquece. Ao mesmo tempo, o núcleo é dilacerado pela repulsão eletrostática entre prótons, pois tem alcance ilimitado. Os núcleos dos elementos mais pesados são, portanto, teoricamente previstos e, até agora, observou-se que decaem principalmente por meio de modos de decaimento que são causados por tal repulsão: decadência alfa e fissão espontânea ; esses modos são predominantes para núcleos de elementos superpesados . Os decaimentos alfa são registrados pelas partículas alfa emitidas e os produtos do decaimento são fáceis de determinar antes do decaimento real; se tal decaimento ou uma série de decaimentos consecutivos produz um núcleo conhecido, o produto original de uma reação pode ser determinado aritmeticamente. A fissão espontânea, entretanto, produz vários núcleos como produtos, de modo que o nuclídeo original não pode ser determinado a partir de suas filhas.
A informação à disposição dos físicos com o objetivo de sintetizar um dos elementos mais pesados são, portanto, as informações coletadas nos detectores: localização, energia e tempo de chegada de uma partícula ao detector e de seu decaimento. Os físicos analisam esses dados e procuram concluir que ele foi de fato causado por um novo elemento e não poderia ter sido causado por um nuclídeo diferente do alegado. Freqüentemente, os dados fornecidos são insuficientes para concluir que um novo elemento foi definitivamente criado e não há outra explicação para os efeitos observados; erros na interpretação dos dados foram cometidos.
História
Tentativas de síntese
Evaporação-fusão
Duas tentativas foram feitas para sintetizar o unbibium na década de 1970, ambas impulsionadas pelas primeiras previsões na ilha de estabilidade em N = 184 e Z > 120, e em particular se os elementos superpesados poderiam potencialmente ocorrer naturalmente. As primeiras tentativas de sintetizar o unbibium foram realizadas em 1972 por Flerov et al. no Joint Institute for Nuclear Research (JINR), usando as reações de fusão a quente induzidas por íons pesados:
-
238
92você
+ 66,68
30Zn
→ 304.306
122Ubb
* → sem átomos
Outra tentativa malsucedida de sintetizar o antibiótico foi realizada em 1978 no GSI Helmholtz Center, onde um alvo natural de érbio foi bombardeado com íons xenônio-136 :
-
nat
68Er
+ 136
54Xe
→ 298.300.302.303.304.306
Ubb
* → sem átomos
Nenhum átomo foi detectado e um limite de rendimento de 5 nb (5.000 pb ) foi medido. Os resultados atuais (ver flerovium ) mostraram que a sensibilidade desses experimentos era muito baixa em pelo menos 3 ordens de magnitude. Em particular, esperava-se que a reação entre 170 Er e 136 Xe produzisse emissores alfa com meia-vida de microssegundos que decairiam para isótopos de flerovium com meia-vida talvez aumentando até várias horas, já que flerovium está previsto para ficar perto do centro da ilha de estabilidade. Após doze horas de irradiação, nada foi encontrado nesta reação. Após uma tentativa sem sucesso semelhante de sintetizar o unbiunium de 238 U e 65 Cu, concluiu-se que as meias-vidas dos núcleos superpesados devem ser menores que um microssegundo ou as seções transversais são muito pequenas. Pesquisas mais recentes sobre a síntese de elementos superpesados sugerem que ambas as conclusões são verdadeiras.
Em 2000, o Gesellschaft für Schwerionenforschung (GSI) Helmholtz Center for Heavy Ion Research realizou um experimento muito semelhante com sensibilidade muito maior:
-
238
92você
+ 70
30Zn
→ 308
122Ubb
* → sem átomos
Esses resultados indicam que a síntese de tais elementos mais pesados continua sendo um desafio significativo e são necessárias melhorias adicionais na intensidade do feixe e na eficiência experimental. A sensibilidade deve ser aumentada para 1 fb no futuro para mais resultados de qualidade.
Fissão do núcleo composto
Vários experimentos estudando as características de fissão de vários núcleos de compostos superpesados, como 306 Ubb, foram realizados entre 2000 e 2004 no Laboratório de Reações Nucleares de Flerov . Duas reações nucleares foram utilizadas, a saber, 248 Cm + 58 Fe e 242 Pu + 64 Ni. Os resultados revelam como os núcleos superpesados se fendem predominantemente pela expulsão de núcleos de concha fechada , como 132 Sn ( Z = 50, N = 82). Verificou-se também que o rendimento da via de fusão-fissão foi semelhante entre projéteis de 48 Ca e 58 Fe, sugerindo um possível uso futuro de projéteis de 58 Fe na formação de elementos superpesados.
Futuro
Cada elemento do mendelévio em diante foi produzido em reações de fusão-evaporação, culminando na descoberta do elemento mais pesado conhecido oganesson em 2002 e, mais recentemente, tennessine em 2010. Essas reações se aproximaram do limite da tecnologia atual; por exemplo, a síntese da tennessina exigiu 22 miligramas de 249 Bk e um intenso feixe de 48 Ca por seis meses. A intensidade dos feixes na pesquisa de elementos superpesados não pode exceder 1012 projéteis por segundo sem danificar o alvo e o detector, e produzir grandes quantidades de alvos actinídeos cada vez mais raros e instáveis é impraticável. Consequentemente, experimentos futuros devem ser feitos em instalações como a fábrica de elementos superpesados em construção (fábrica SHE) no Instituto Conjunto de Pesquisa Nuclear (JINR) ou RIKEN , o que permitirá que os experimentos sejam executados por períodos mais longos de tempo com maior detecção capacidades e permitir reações de outra forma inacessíveis.
É possível que as reações de fusão-evaporação não sejam adequadas para a descoberta de antibióticos ou elementos mais pesados. Vários modelos prevêem meias-vidas de fissão espontânea e alfa cada vez mais curtas para isótopos com Z = 122 e N ~ 180 na ordem de microssegundos ou menos, tornando a detecção quase impossível com o equipamento atual. O crescente domínio da fissão espontânea também pode cortar possíveis laços com núcleos conhecidos de livermorium ou oganesson e tornar a identificação e a confirmação mais difíceis; um problema semelhante ocorreu no caminho para a confirmação da cadeia de decaimento de 294 Og que não tem âncora para núcleos conhecidos. Por essas razões, outros métodos de produção podem precisar ser pesquisados, como reações de transferência de múltiplos núcleos capazes de povoar núcleos de vida mais longa. Uma mudança semelhante na técnica experimental ocorreu quando a fusão a quente usando projéteis de 48 Ca foi usada em vez da fusão a frio (na qual as seções transversais diminuem rapidamente com o aumento do número atômico) para povoar elementos com Z > 113.
No entanto, várias reações de fusão-evaporação levando ao antibiótico foram propostas além daquelas já tentadas sem sucesso, embora nenhuma instituição tenha planos imediatos para fazer tentativas de síntese, em vez disso, focando primeiro nos elementos 119, 120 e possivelmente 121. Porque as seções transversais aumentam com assimetria da reação, um feixe de cromo seria mais favorável em combinação com um alvo de califórnio , especialmente se a camada de nêutrons fechada prevista em N = 184 pudesse ser alcançada em produtos mais ricos em nêutrons e conferisse estabilidade adicional. Em particular, a reação entre54
24Cr
e 252
98Cf
geraria o núcleo composto 306
122Ubb
e alcançar a casca em N = 184, embora a reação análoga com um249
98Cf
alvo é considerado mais viável devido à presença de produtos de fissão indesejados de252
98Cf
e dificuldade em acumular a quantidade necessária de material alvo. Uma possível síntese de unbibium poderia ocorrer da seguinte forma:
-
249
98Cf
+ 54
24Cr
→ 300
122Ubb
+ 3 1
0
n
Se esta reação for bem-sucedida e o decaimento alfa permanecer dominante sobre a fissão espontânea, o 300 Ubb resultante decairia através de 296 Ubn, que pode ser povoado em bombardeio cruzado entre 249 Cf e 50 Ti. Embora essa reação seja uma das opções mais promissoras para a síntese de antibióticos em um futuro próximo, a seção transversal máxima está prevista para ser de 3 fb , uma ordem de magnitude menor do que a seção transversal mais baixa medida em uma reação bem-sucedida. As reações mais simétricas 244 Pu + 64 Ni e 248 Cm + 58 Fe também foram propostas e podem produzir isótopos mais ricos em nêutrons. Com o aumento do número atômico, deve-se também estar ciente da diminuição das alturas das barreiras de fissão , resultando em menor probabilidade de sobrevivência de núcleos compostos , especialmente acima dos números mágicos previstos em Z = 126 e N = 184.
Descoberta reivindicada como um elemento de ocorrência natural
Em 2008, um grupo liderado por físico israelita Amnon Marinov no Hebrew University of Jerusalém, afirmaram ter encontrado átomos individuais de 292-unbibium em que ocorre naturalmente tório depósitos a uma abundância de entre 10 -11 e 10 -12 em relação ao tório. Foi a primeira vez em 69 anos que se afirmou que um novo elemento foi descoberto na natureza, após a descoberta do frâncio por Marguerite Perey em 1939 . A afirmação de Marinov et al. foi criticado por uma parte da comunidade científica, e Marinov diz que submeteu o artigo às revistas Nature e Nature Physics, mas ambos recusaram sem enviá-lo para avaliação por pares. Os átomos de unbibium-292 foram reivindicados para ser superdeformed ou hyperdeformed isómeros , com uma meia-vida de pelo menos 100 milhões de anos.
Uma crítica à técnica, anteriormente usada na suposta identificação de isótopos de tório mais leves por espectrometria de massa , foi publicada na Physical Review C em 2008. Uma refutação do grupo Marinov foi publicada na Physical Review C após o comentário publicado.
Uma repetição do experimento de tório usando o método superior de espectrometria de massa do acelerador (AMS) não conseguiu confirmar os resultados, apesar de uma sensibilidade 100 vezes melhor. Este resultado lança dúvidas consideráveis sobre os resultados da colaboração de Marinov no que diz respeito às suas reivindicações de isótopos de longa duração de tório , roentgênio e antibíbio. Ainda é possível que existam vestígios de unbibium em algumas amostras de tório, embora, dado o conhecimento atual dos elementos superpesados, isso seja muito improvável.
Nomeação
Usando nomenclatura de Mendeleev para elementos não identificados e não descobertos , unbibium deve preferivelmente ser conhecido como eka- tório . Após as recomendações da IUPAC em 1979, o elemento tem sido amplamente referido como unbibium com o símbolo atômico de ( Ubb ), como seu nome temporário até que o elemento seja oficialmente descoberto e sintetizado, e um nome permanente seja decidido. Os cientistas ignoram amplamente essa convenção de nomenclatura e, em vez disso, simplesmente se referem ao unbibium como "elemento 122" com o símbolo de ( 122 ), ou às vezes até mesmo E122 ou 122 .
Propriedades previstas
Estabilidade nuclear e isótopos

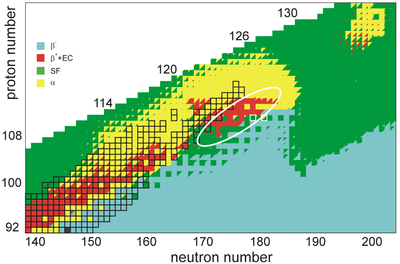
A estabilidade dos núcleos diminui muito com o aumento do número atômico após o plutônio , o elemento primordial mais pesado , de modo que todos os isótopos com número atômico acima de 101 decaem radioativamente com meia-vida inferior a um dia, com exceção do dubnium -268. Nenhum elemento com número atômico acima de 82 (após o chumbo ) possui isótopos estáveis. No entanto, por razões ainda não muito bem compreendidas, há um ligeiro aumento da estabilidade nuclear em torno dos números atômicos 110 - 114 , o que leva ao surgimento do que é conhecido na física nuclear como a " ilha de estabilidade ". Este conceito, proposto por Universidade da Califórnia professor de Glenn Seaborg , explica por elementos superpesados durar mais tempo do que o previsto.
Nesta região da tabela periódica, N = 184 foi sugerido como uma camada de nêutrons fechada , e vários números atômicos foram propostos como camadas de prótons fechadas, como Z = 114, 120, 122, 124 e 126. A ilha de a estabilidade seria caracterizada por meias-vidas mais longas de núcleos localizados perto desses números mágicos, embora a extensão dos efeitos de estabilização seja incerta devido às previsões de enfraquecimento dos fechamentos da camada de prótons e possível perda de dupla magicidade . Pesquisas mais recentes prevêem que a ilha de estabilidade será centrada nos isótopos de copernício beta-estáveis 291 Cn e 293 Cn, o que colocaria o antibiótico bem acima da ilha e resultaria em meias-vidas curtas, independentemente dos efeitos da casca. O aumento da estabilidade dos elementos 112-118 também foi atribuído à forma oblata de tais núcleos e resistência à fissão espontânea. O mesmo modelo também propõe 306 Ubb como o próximo núcleo esférico duplamente mágico, definindo assim a verdadeira ilha de estabilidade para núcleos esféricos.

Um modelo de tunelamento quântico prevê que as meias-vidas de decaimento alfa dos isótopos de antibióticos 284-322 Ubb sejam da ordem de microssegundos ou menos para todos os isótopos mais leves que 315 Ubb, destacando um desafio significativo na observação experimental deste elemento. Isso é consistente com muitas previsões, embora a localização exata da borda de 1 microssegundo varie de acordo com o modelo. Além disso, espera-se que a fissão espontânea se torne o principal modo de decaimento nesta região, com meias-vidas na ordem dos femtossegundos previstas para alguns isótopos pares devido ao impedimento mínimo resultante do emparelhamento de núcleos e perda de efeitos estabilizadores mais distantes dos números mágicos . Um cálculo de 2016 sobre as meias-vidas e cadeias de decaimento prováveis de isótopos 280-339 Ubb produz resultados corroborantes: 280-297 Ubb será desvinculado de prótons e possivelmente decai por emissão de prótons , 298-314 Ubb terá meias-vidas alfa na ordem de microssegundos, e aqueles mais pesados do que 314 Ubb irão decair predominantemente por fissão espontânea com meia-vida curta. Para os emissores alfa mais leves que podem ser povoados em reações de fusão-evaporação, algumas longas cadeias de decaimento que levam a isótopos conhecidos ou alcançáveis de elementos mais leves são previstas. Além disso, os isótopos 308-310 Ubb está previsto para ter meias-vidas sob um microssegundo, demasiado curta para a detecção como resultado de diminuir significativamente a energia de ligação para os números de neutrões imediatamente acima da N fecho casca = 184. Alternativamente, uma segunda ilha de estabilidade com meia-vida total de aproximadamente 1 segundo pode existir em torno de Z ~ 124 e N ~ 198, embora esses núcleos sejam difíceis ou impossíveis de alcançar usando as técnicas experimentais atuais. No entanto, essas previsões são fortemente dependentes dos modelos de massa nuclear escolhidos, e não se sabe quais isótopos de unbibium serão mais estáveis. Independentemente disso, esses núcleos serão difíceis de sintetizar, pois nenhuma combinação de alvo obtido e projétil pode fornecer nêutrons suficientes no núcleo composto. Mesmo para núcleos alcançáveis em reações de fusão, a fissão espontânea e possivelmente também a decadência do cluster podem ter ramificações significativas, representando outro obstáculo para a identificação de elementos superpesados, pois eles são normalmente identificados por seus sucessivos decaimentos alfa.
Químico
Prevê-se que o Unbibium seja semelhante em química ao cério e ao tório, que da mesma forma têm quatro elétrons de valência acima de um núcleo de gás nobre, embora possa ser mais reativo. Além disso, o unbibium está previsto para pertencer a um novo bloco de átomos de elétron-g de valência , embora o orbital 5g não deva começar a encher até cerca do elemento 125. A configuração eletrônica do estado fundamental do unbibium prevista é [ Og ] 7d 1 8s 2 8p 1 ou 8s 2 8p 2 , em contraste com o esperado [ Og ] 5g 2 8s 2 em que o orbital 5g começa a preencher no elemento 121. (As configurações ds 2 p e s 2 p 2 devem ser separadas apenas por cerca de 0,02 eV.) Nos superactinídeos, os efeitos relativísticos podem causar uma quebra do princípio de Aufbau e criar sobreposição dos orbitais 5g, 6f, 7d e 8p; experimentos na química de copernicium e flerovium fornecem fortes indícios do papel crescente dos efeitos relativísticos. Como tal, a química dos elementos que seguem o antibiótico torna-se mais difícil de prever.
O Unbibium provavelmente formaria um dióxido, Ubb O 2 , e tetrahaletos, como Ubb F 4 e Ubb Cl 4 . Prevê-se que o principal estado de oxidação seja +4, semelhante ao cério e tório. Uma primeira energia de ionização de 5,651 eV e a segunda energia de ionização de 11,332 eV são previstas para o antibiótico; esta e outras energias de ionização calculadas são menores do que os valores análogos para o tório, sugerindo que o antibiótico será mais reativo do que o tório.
Notas
Referências
Bibliografia
- Audi, G .; Kondev, FG; Wang, M .; Huang, WJ; Naimi, S. (2017). "A avaliação NUBASE2016 das propriedades nucleares" (PDF) . Chinese Física C . 41 (3): 030001. bibcode : 2017ChPhC..41c0001A . doi : 10.1088 / 1674-1137 / 41/3/030001 .
- Beiser, A. (2003). Conceitos de física moderna (6ª ed.). McGraw-Hill. ISBN 978-0-07-244848-1. OCLC 48965418 .
- Hoffman, DC ; Ghiorso, A .; Seaborg, GT (2000). The Transuranium People: The Inside Story . World Scientific . ISBN 978-1-78-326244-1.
- Hoffman, DC; Lee, DM; Pershina, V. (2006). "Transactinides e os elementos futuros". Em Morss, LR; Edelstein, NM; Fuger, J. (eds.). The Chemistry of the Actinide and Transactinide Elements . 3 (3ª ed.). Dordrecht, Holanda: Springer . p. 1652–1752. ISBN 1-4020-3555-1.
- Kragh, H. (2018). De elementos transurânicos a superpesados: uma história de disputa e criação . Springer . ISBN 978-3-319-75813-8.
- Zagrebaev, V .; Karpov, A .; Greiner, W. (2013). "Futuro da pesquisa com elementos superpesados: quais núcleos podem ser sintetizados nos próximos anos?". Journal of Physics: Conference Series . 420 . 012001. arXiv : 1207.5700 . Bibcode : 2013JPhCS.420a2001Z . doi : 10.1088 / 1742-6596 / 420/1/012001 . ISSN 1742-6588 . S2CID 55434734 .
