Nitrato de vanadil - Vanadyl nitrate
|
|
| Nomes | |
|---|---|
| Outros nomes
trinitratooxovanádio
|
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| ChemSpider | |
|
PubChem CID
|
|
|
|
|
|
| Propriedades | |
| VO (NO 3 ) 3 | |
| Massa molar | 252,953 g / mol |
| Aparência | líquido amarelo. |
| Ponto de fusão | 2 ° C (36 ° F; 275 K) |
| Ponto de ebulição | 86 a 91 ° C (187 a 196 ° F; 359 a 364 K) a 0,7 mm Hg |
| agua | |
| Perigos | |
| Riscos principais | oxidante |
| Compostos relacionados | |
|
Compostos relacionados
|
nitrato de titânio , perclorato de vanadil |
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|
| Referências da Infobox | |
O nitrato de vanadil , também chamado de oxitrinitrato de vanádio ou oxinitrato de vanádio, é um composto inorgânico de vanádio no estado de oxidação +5 com ligantes nitrato e oxigênio. A fórmula é VO (NO 3 ) 3 . É um líquido viscoso amarelo claro.
Produção
É feito embebendo pentóxido de vanádio em pentóxido de dinitrogênio líquido por durações de cerca de dois dias em temperatura ambiente. O rendimento para este método é de cerca de 85%.
- V 2 O 5 + 3 N 2 O 5 → 2 VO (NO 3 ) 3 .
A purificação pode ser obtida por destilação a vácuo.
O mononitratodioxovanádio (VO 2 NO 3 ) é um intermediário nessa síntese. É um sólido vermelho tijolo.
O nitrato de vanadil também pode ser feito a partir do tricloreto de vanadil VOCl 3 e do pentóxido de dinitrogênio.
Estrutura
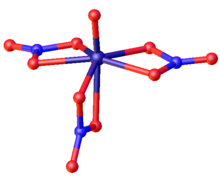
VO (NO 3 ) 3 tem uma forma bipiramidal pentagonal distorcida com simetria C s (espelho) idealizada . A ligação de oxigênio de vanádio (157,2 pm) é típica para vanadil (V). Dois grupos de nitrato no plano pentagonal são bidentados (distâncias VO variam de 199 a 206 pm). O terceiro nitrato abrange o plano pentagonal (197 pm) para a posição trans para oxo (223 pm).
Propriedades
O nitrato de vanadil dissolve-se em diclorometano, nitrometano, tetracloreto de carbono e hidrocarbonetos saturados. 1-hexeno, ou outros hidrocarbonetos insaturados inflamam ao entrar em contato com nitrato de vanadil. Ao entrar em contato com a água, hidrolisa-se irreversivelmente, liberando ácido nítrico . O ácido nítrico é formado como resultado da reação com a água.
O espectro ultravioleta do líquido mostra uma banda de absorção com pico em 208 nm com um ombro em 242 nm. A 55 ° C, o nitrato de vanadil gasoso tem bandas de absorção também a 486, 582 e 658 nm no espectro de luz visual. na região do infravermelho, o nitrato de vanadil líquido absorve em 1880, 1633, 1612, 1560, 1306, 1205, 1016, 996, 965, 895, 783, 632, 457, 357, 301, 283, 234, 193, 133, 93 e 59 cm −1 . Nitrato de vanadil gasoso tem bandas de absorção em 775, 783, 786, 962,5, 994,4, 997,5, 1000,5, 1006,2, 1012, 1016,3, 1020, 1198, 1211, 1216,3, 1564, 1612, 1629, 1632, 1635, 1648 e 1888 cm - 1 . Muitas dessas bandas são devido ao alongamento nas ligações nitrogênio-oxigênio, mas 1016,3 cm- 1 é devido à ligação dupla vanádio-oxigênio. 786 é devido a oscilação fora de fase em NO e 775 é devido à deformação em ON = O no plano do espelho.
Reações
É um agente nitrante para compostos aromáticos. As reações ocorrem à temperatura ambiente. Freqüentemente, o diclorometano é usado como solvente inerte. Nitrotolueno, benzoato de metila e ácido benzóico são nitrados por exposição prolongada por alguns dias. O benzonitrila não reage.
O nitrato de vanadil forma um aducto sólido amarelo pálido com trifluoreto de boro . Um aduto também é formado com acetonitrila .
Referências
- ^ a b c d e f Pomba, Michael FA; Berthold Manz; John Montgomery; Gerald Pattenden; Simon A. Wood (1998). "Oxitrinitrato de vanádio (V), VO (NO3) 3. Um poderoso reagente para a nitração de compostos aromáticos à temperatura ambiente sob condições não ácidas". Journal of the Chemical Society, Perkin Transactions 1 (10): 1589–1590. doi : 10.1039 / A801771I . ISSN 0300-922X .
- ^ a b c Brandán, Silvia A .; C. Socolsky; Aida Ben Altabef (2009). "Cálculos DFT do campo de força molecular do nitrato de vanadil, VO (NO3) 3". Zeitschrift für anorganische und allgemeine Chemie . 635 (3): 582–592. doi : 10.1002 / zaac.200801244 . ISSN 0044-2313 .
- ^ a b c d e Harris, Arlo D .; John C. Trebellas (26 de abril de 1962). "AD296097 Experimental Studies of the Reactions of N2O5 with Metal Acid Anhydrides and BF3" . Arlington Hall Station: Armed Services Technical Information Agency . Retirado em 30 de setembro de 2014 .
- ^ Algodão, F. Albert; Wilkinson, Geoffrey (1966). Advanced Inorganic Chemistry A Comprehensive Text (5 ed.). John Wiley. p. 814.
- ^ Pantonin, John A .; Albert K. Fischer; Edward A. Heintz (1960). "A preparação de mononitratodioxovanadium (V), VO2NO3". Journal of Inorganic and Nuclear Chemistry . 14 (1–2): 145–147. doi : 10.1016 / 0022-1902 (60) 80220-5 . ISSN 0022-1902 .
- ^ Schmeisser, Martin (1955). "Die Chemie der anorganischen Acylnitrate (ein Problem des Nitrylchlorids) und Acylperchlorate (ein Problem des Dichlorhexoxyds)". Angewandte Chemie (em alemão). 67 (17–18): 493–501. doi : 10.1002 / ange.19550671708 . ISSN 0044-8249 .
- ^ Smart, Bruce A .; Heather E. Robertson; David WH Rankin; Eric G. Hope; Colin J. Marsden (1999). "Qual é o número de coordenação do vanádio em nitrato de vanadila, VO (NO3) 3? Um estudo de sua estrutura molecular na fase gasosa por difração de elétrons e cálculos ab initio". Journal of the Chemical Society, Dalton Transactions (3): 473–478. doi : 10.1039 / A806710D . ISSN 0300-9246 . (download grátis)
- ^ Davidson, G. (01/01/2000). Propriedades espectroscópicas de compostos inorgânicos e organometálicos . Royal Society of Chemistry. pp. 516–517. ISBN 9780854044269. Retirado em 30 de setembro de 2014 .
- ^ Fedoroff, Basil T; Sheffield, Oliver E. Enciclopédia de explosivos e artigos afins Vol 10 de 10 U a Z . 10 . p. V4.
- ^ a b c Brandán, SA; A. Ben Altabef, EL Varetti; Varetti, EL (1995). "Espectro vibracional e eletrônico de nitrato de vanadila, VO (NO3) 3". Spectrochimica Acta Parte A: Espectroscopia Molecular e Biomolecular . 51 (4): 669–675. Bibcode : 1995AcSpA..51..669B . doi : 10.1016 / 0584-8539 (94) 00154-4 . ISSN 1386-1425 .
- ^ Aitken, R. Alan; Alajarin, Mateo; Allen, DW; Mikael Begtrup; Daniel Bellus; J. Berna-Canovas; H. Boeckemeier; Stefan Bräse; IR Butler; Jose Chiara; Henri-J. Cristau; I. Gorrell; D. Keck; Terence Kee; Carmen Lopez-Leonardo; T. Muller; Patrick J. Murphy; Patrick O'Leary; Beate Priewisch; LK Rasmussen; Karola Rück-Braun; Bjoern Schlummer; Andreas Schmidt; Paul James Stevenson; JC Tebby; David Virieux (2014-05-14). Science of Synthesis: Houben-Weyl Methods of Molecular Transformations Vol. 31b: Arene-X (X = N, P) . Georg Thieme Verlag. p. 1215. ISBN 9783131720719. Retirado em 29 de setembro de 2014 .
Outra leitura
- Gmelin, Syst No 48, Teil A & Teil B (Lieferung 1 e 2) (1967); Teil A (Lieferung 1) e Teil A (Lieferung 2) (1968); & Erganzungwerk (Band2) (1971)
- M. Schmeisser, "Chemical Abstracts", (1955), 49, 10873
- L. Bretherick, Ed, "Hazards in the Chemical Laboratory", Royal Society of Chemistry, London, Engl (1979), pg. 1160
