Álcool vinílico - Vinyl alcohol
|
|
|||
| Nomes | |||
|---|---|---|---|
|
Nome IUPAC preferido
Etenol |
|||
| Outros nomes
Hidroxietileno
Hidroxietileno |
|||
| Identificadores | |||
|
Modelo 3D ( JSmol )
|
|||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard |
100,008,350 |
||
|
PubChem CID
|
|||
|
Painel CompTox ( EPA )
|
|||
|
|||
|
|||
| Propriedades | |||
| C 2 H 4 O | |||
| Massa molar | 44,053 g / mol | ||
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|||
|
|
|||
| Referências da Infobox | |||
O álcool vinílico , também chamado de etenol (nome IUPAC), é o enol mais simples . Com a fórmula C H 2 CH O H, é um composto lábil que se converte em acetaldeído . Não é um precursor do álcool polivinílico .
Síntese
O álcool vinílico pode ser formado pela eliminação pirolítica da água do etilenoglicol a uma temperatura de 900 ° C e baixa pressão.
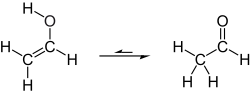
Tautomerização de álcool vinílico em acetaldeído
Em condições normais, o álcool vinílico se converte ( tautomeriza ) em acetaldeído :
À temperatura ambiente, o acetaldeído (H 3 CC (O) H) é mais estável do que o álcool vinílico (H 2 C = CHOH) em 42,7 kJ / mol:
- H 2 C = CHOH → H 3 CC (O) H Δ H 298, G = -42,7 kJ / mol

O tautomerismo ceto-enol não catalisado por uma migração de 1,3-hidrogênio é proibido pelas regras de Woodward-Hoffmann e, portanto, tem uma barreira de ativação alta e não é um caminho significativo em ou próximo à temperatura ambiente. No entanto, mesmo traços de ácidos ou bases (incluindo água) podem catalisar a reação. Mesmo com precauções rigorosas para minimizar a umidade acidental ou as fontes de prótons, o álcool vinílico só pode ser armazenado por minutos a horas antes de se isomerizar em acetaldeído. ( O ácido carbônico é outro exemplo de uma substância que é estável quando rigorosamente pura, mas se decompõe rapidamente devido à catálise por vestígios de umidade.)
A tautomerização também pode ser catalisada via processo fotoquímico. Esses achados sugerem que a tautomerização ceto-enólica é uma rota viável em condições atmosféricas e estratosféricas, relevante para um papel do álcool vinílico na produção de ácidos orgânicos na atmosfera.
O álcool vinílico pode ser estabilizado controlando a concentração de água no sistema e utilizando a favorabilidade cinética do efeito do isótopo cinético produzido pelo deutério ( k H + / k D + = 4,75, k H 2 O / k D 2 O = 12). A estabilização do deutério pode ser realizada por meio da hidrólise de um precursor de ceteno na presença de um leve excesso estequiométrico de água pesada (D 2 O). Estudos mostram que o processo de tautomerização é significativamente inibido à temperatura ambiente ( k t ≈ 10 -6 M / s), e a meia-vida da forma enol pode ser facilmente aumentada para t 1/2 = 42 minutos para hidrólise de primeira ordem cinética.
Relação com poli (álcool vinílico)
Por causa da instabilidade do álcool vinílico, o álcool polivinílico termoplástico (PVA ou PVOH) é feito indiretamente pela polimerização do acetato de vinila seguida pela hidrólise das ligações éster (Ac = acetil; HOAc = ácido acético):
- n CH 2 = CHOAc → (CH 2 -CHOAc) n
- (CH 2 −CHOAc) n + n H 2 O → (CH 2 −CHOH) n + n HOAc
Como um ligante
Vários complexos de metal são conhecidos que contêm álcool vinílico como ligante . Um exemplo é Pt (acac) (η 2 -C 2 H 3 OH) Cl.
Ocorrência em meio interestelar
Álcool vinílico foi detectado na nuvem molecular de Sagitário B. Sua estabilidade no meio interestelar (diluído) mostra que sua tautomerização não ocorre unimolecularmente .