Xenotransplante - Xenotransplantation
| Xenotransplante | |
|---|---|
|
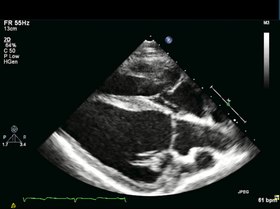
Ecocardiografia de eixo longo. Ecocardiografia representativa de visão de eixo longo, 4 semanas após o infarto do miocárdio (MI), logo antes da infusão de CMPC / placebo. O adelgaçamento e a acinesia da parede septal apical devido ao IM podem ser observados.
| |
| Malha | D014183 |
Xenotransplante ( xenos- do grego que significa "estranho" ou estranho), ou transplante heterólogo , é o transplante de células , tecidos ou órgãos vivos de uma espécie para outra. Essas células, tecidos ou órgãos são chamados de xenoenxertos ou xenotransplantes . É contrastado com alotransplante (de outro indivíduo da mesma espécie), transplante singênico ou isotransplante (enxertos transplantados entre dois indivíduos geneticamente idênticos da mesma espécie) e autotransplante (de uma parte do corpo para outra na mesma pessoa).
O xenotransplante de células tumorais humanas em camundongos imunocomprometidos é uma técnica de pesquisa frequentemente usada em pesquisas oncológicas pré-clínicas .
O xenotransplante humano oferece um tratamento potencial para a falência de órgãos em estágio terminal , um problema de saúde significativo em partes do mundo industrializado . Também levanta muitas novas questões médicas, legais e éticas. Uma preocupação constante é que muitos animais, como porcos , têm uma vida útil mais curta do que os humanos, o que significa que seus tecidos envelhecem em um ritmo mais rápido. A transmissão de doenças ( xenozoonose ) e a alteração permanente do código genético dos animais também são preocupantes. Da mesma forma que as objeções aos testes em animais , os ativistas dos direitos dos animais também se opuseram ao xenotransplante por motivos éticos. Alguns casos de xenotransplante temporariamente bem-sucedidos são publicados.
É comum que pacientes e médicos usem o termo "aloenxerto" de forma imprecisa para se referir a aloenxerto (humano para humano) ou xenoenxerto (animal para humano), mas é útil cientificamente (para aqueles que procuram ou lêem o científico literatura ) para manter uma distinção mais precisa no uso .
História
As primeiras tentativas sérias de xenotransplante (então chamado de heterotransplante) apareceram na literatura científica em 1905, quando fatias de rim de coelho foram transplantadas em uma criança com doença renal crônica . Nas primeiras duas décadas do século 20, vários esforços subsequentes para usar órgãos de cordeiros, porcos e primatas foram publicados.
O interesse científico no xenotransplante diminuiu quando a base imunológica do processo de rejeição do órgão foi descrita. As próximas ondas de estudos sobre o assunto vieram com a descoberta de drogas imunossupressoras . Ainda mais estudos seguiram o primeiro transplante renal bem-sucedido do Dr. Joseph Murray em 1954 e os cientistas, enfrentando as questões éticas da doação de órgãos pela primeira vez, aceleraram seus esforços na busca de alternativas aos órgãos humanos.
Em 1963, médicos da Universidade de Tulane tentaram transplantes renais de chimpanzé para humanos em seis pessoas que estavam à beira da morte; depois disso e de várias tentativas subsequentes sem sucesso de usar primatas como doadores de órgãos e do desenvolvimento de um programa de busca de órgãos para cadáveres, o interesse no xenotransplante para insuficiência renal se dissipou. Dos 13 transplantes realizados por Keith Reemtsma, um receptor de rim viveu 9 meses, voltando a trabalhar como professor. Na autópsia, os rins do chimpanzé pareciam normais e não mostraram sinais de rejeição aguda ou crônica.
Uma menina americana conhecida como " Baby Fae " com síndrome do coração esquerdo hipoplásico foi a primeira criança a receber um xenotransplante, quando recebeu um coração de babuíno em 1984. O procedimento foi realizado por Leonard Lee Bailey no Loma Linda University Medical Center em Loma Linda , Califórnia . Fae morreu 21 dias depois devido a uma rejeição de enxerto de base humoral que se pensava ser causada principalmente por uma incompatibilidade de tipo sanguíneo ABO , considerada inevitável devido à raridade dos babuínos do tipo O. O enxerto deveria ser temporário, mas infelizmente não foi possível encontrar uma substituição adequada do aloenxerto a tempo. Embora o procedimento em si não tenha feito avançar o progresso do xenotransplante, ele lançou uma luz sobre a quantidade insuficiente de órgãos para bebês. A história cresceu tanto que teve um impacto tão grande que a crise de escassez de órgãos infantis melhorou naquela época.
O xenotransplante de células tumorais humanas em camundongos imunocomprometidos é uma técnica de pesquisa frequentemente usada em pesquisas oncológicas. É usado para prever a sensibilidade do tumor transplantado a vários tratamentos de câncer; várias empresas oferecem este serviço, incluindo o Laboratório Jackson .
Órgãos humanos foram transplantados para animais como uma técnica de pesquisa poderosa para estudar a biologia humana sem prejudicar os pacientes humanos. Esta técnica também foi proposta como uma fonte alternativa de órgãos humanos para futuros transplantes em pacientes humanos. Por exemplo, pesquisadores do Ganogen Research Institute transplantaram rins fetais humanos em ratos que demonstraram função de suporte vital e crescimento.
Usos potenciais
Uma escassez mundial de órgãos para implantação clínica faz com que cerca de 20–35% dos pacientes que precisam de órgãos de reposição morram na lista de espera. Certos procedimentos, alguns dos quais estão sendo investigados nos primeiros ensaios clínicos, objetivam usar células ou tecidos de outras espécies para tratar doenças debilitantes e fatais, como câncer , diabetes , insuficiência hepática e doença de Parkinson . Se a vitrificação puder ser aperfeiçoada, poderá permitir o armazenamento a longo prazo de células, tecidos e órgãos xenogênicos, de modo que estejam mais prontamente disponíveis para transplante.
Os xenotransplantes podem salvar milhares de pacientes que aguardam órgãos doados. O órgão animal, provavelmente de um porco ou babuíno, poderia ser geneticamente alterado com genes humanos para enganar o sistema imunológico de um paciente e fazê-lo aceitá-lo como parte de seu próprio corpo. Eles ressurgiram devido à falta de órgãos disponíveis e à batalha constante para impedir que o sistema imunológico rejeite os alotransplantes. Os xenotransplantes são, portanto, potencialmente uma alternativa mais eficaz.
O xenotransplante também é e tem sido uma ferramenta valiosa usada em laboratórios de pesquisa para estudar a biologia do desenvolvimento .
Os xenoenxertos de tumor derivados de pacientes em animais podem ser usados para testar tratamentos.
Potenciais doadores de órgãos de animais
Uma vez que são os parentes mais próximos dos humanos, os primatas não humanos foram inicialmente considerados como uma fonte potencial de órgão para xenotransplante em humanos. Os chimpanzés foram originalmente considerados a melhor opção, pois seus órgãos são de tamanho semelhante e têm boa compatibilidade de tipo sanguíneo com humanos, o que os torna candidatos potenciais para xenotransfusões . No entanto, uma vez que os chimpanzés são listados como uma espécie em extinção, outros doadores potenciais foram procurados. Os babuínos estão mais facilmente disponíveis, mas impraticáveis como doadores em potencial. Os problemas incluem o tamanho corporal menor, a infrequência do grupo sanguíneo O (o doador universal), o longo período de gestação e o número tipicamente pequeno de descendentes. Além disso, um grande problema com o uso de primatas não humanos é o aumento do risco de transmissão de doenças, uma vez que são parentes próximos dos humanos.
Atualmente, acredita-se que os porcos ( Sus scrofa domesticus ) sejam os melhores candidatos à doação de órgãos. O risco de transmissão de doenças entre espécies é reduzido devido ao aumento da distância filogenética dos humanos. Os porcos têm períodos de gestação relativamente curtos, ninhadas grandes e são fáceis de criar, tornando-os prontamente disponíveis. Eles são baratos e fáceis de manter em instalações livres de patógenos, e as ferramentas atuais de edição de genes são adaptadas para porcos para combater a rejeição e potenciais zoonoses. Órgãos de porcos são anatomicamente comparáveis em tamanho, e novos agentes infecciosos são menos prováveis, uma vez que estão em contato próximo com humanos por meio da domesticação por muitas gerações. Os tratamentos com origem em porcos provaram ser bem-sucedidos, como a insulina derivada de suínos para pacientes com diabetes mellitus. Cada vez mais, porcos geneticamente modificados estão se tornando a norma, o que levanta dúvidas morais, mas também aumenta a taxa de sucesso do transplante. Os experimentos atuais em xenotransplante geralmente usam porcos como doadores e babuínos como modelos humanos.
No campo da medicina regenerativa, embriões de porco com deficiência de pancreatogênese ou nefrogênese, incapazes de formar um órgão específico, permitem a experimentação para a geração in vivo de órgãos funcionais a partir de células-tronco pluripotentes xenogênicas em grandes animais via compensação para um nicho de desenvolvimento vazio (blastocisto complementação). Esses experimentos fornecem a base para a potencial aplicação futura de complementação de blastocisto para gerar órgãos humanos transplantáveis a partir das próprias células do paciente, usando animais de criação, para aumentar a qualidade de vida daqueles com falência orgânica em estágio terminal.
Barreiras e problemas
Barreiras imunológicas
Até o momento, nenhum ensaio de xenotransplante foi totalmente bem-sucedido devido aos muitos obstáculos decorrentes da resposta do sistema imunológico do receptor . As "xenozoonoses" são uma das maiores ameaças às rejeições, pois são infecções xenogenéticas. A introdução desses microrganismos é um grande problema que leva às infecções fatais e, posteriormente, à rejeição dos órgãos. Essa resposta, que geralmente é mais extrema do que nos alotransplantes, acaba resultando na rejeição do xenoenxerto e pode, em alguns casos, resultar na morte imediata do receptor. Existem vários tipos de rejeição que os xenoenxertos enfrentam, incluindo rejeição hiperaguda, rejeição vascular aguda, rejeição celular e rejeição crônica.
Uma resposta rápida, violenta e hiperaguda ocorre como resultado dos anticorpos presentes no organismo hospedeiro. Esses anticorpos são conhecidos como anticorpos naturais xenorreativos (XNAs).
Rejeição hiperaguda
Este tipo de rejeição rápida e violenta ocorre dentro de minutos a horas a partir do momento do transplante. É mediada pela ligação de XNAs (anticorpos naturais xenorreativos) ao endotélio do doador, causando ativação do sistema complemento humano , o que resulta em dano endotelial, inflamação, trombose e necrose do transplante. Os XNAs são produzidos pela primeira vez e começam a circular no sangue em neonatos, após a colonização do intestino por bactérias com frações de galactose em suas paredes celulares. A maioria desses anticorpos são da classe IgM , mas também incluem IgG e IgA .
O epítopo XNAs alvo é uma porção de galactose ligada a α, Gal-α-1,3Gal (também chamada de epítopo α-Gal), produzida pela enzima α-galactosil transferase. A maioria dos não primatas contém essa enzima, portanto, esse epítopo está presente no epitélio do órgão e é percebido como um antígeno estranho pelos primatas, que não possuem a enzima galactosil transferase. No xenotransplante de porco para primata, os XNAs reconhecem glicoproteínas porcinas da família das integrinas.
A ligação de XNAs inicia a ativação do complemento através da via clássica do complemento . A ativação do complemento causa uma cascata de eventos que levam a: destruição das células endoteliais, desgranulação plaquetária, inflamação, coagulação, deposição de fibrina e hemorragia. O resultado final é trombose e necrose do xenoenxerto.
Superando a rejeição hiperaguda
Uma vez que a rejeição hiperaguda representa uma barreira para o sucesso dos xenoenxertos, várias estratégias para superá-la estão sob investigação:
Interrupção da cascata do complemento
- A cascata do complemento do receptor pode ser inibida através do uso de fator de veneno de cobra (que esgota C3), receptor de complemento solúvel tipo 1, anticorpos anti-C5 ou inibidor de C1 (C1-INH). As desvantagens dessa abordagem incluem a toxicidade do fator de veneno da cobra e, o mais importante, esses tratamentos privariam o indivíduo de um sistema complemento funcional.
Órgãos transgênicos (porcos geneticamente modificados)
- Nocaute do gene da 1,3 galactosil transferase - Esses porcos não contêm o gene que codifica a enzima responsável pela expressão da porção imunogênica gal-α-1,3Gal (o epítopo α-Gal).
- Aumento da expressão de H-transferase (α 1,2 fucosiltransferase), uma enzima que compete com a galactosil transferase. Experimentos mostraram que isso reduz a expressão de α-Gal em 70%.
- Expressão de reguladores do complemento humano ( CD55 , CD46 e CD59 ) para inibir a cascata do complemento.
- A plasmaforese, em humanos, para remover 1,3 galactosiltransferase, reduz o risco de ativação de células efetoras como CTL (células T CD8), ativação da via do complemento e hipersensibilidade do tipo retardado (DTH).
Rejeição vascular aguda
Também conhecido como rejeição xenoativa retardada, esse tipo de rejeição ocorre em xenoenxertos discordantes em 2 a 3 dias, se a rejeição hiperaguda for evitada. O processo é muito mais complexo do que a rejeição hiperaguda e atualmente não é totalmente compreendido. A rejeição vascular aguda requer a síntese de proteínas de novo e é impulsionada por interações entre as células endoteliais do enxerto e os anticorpos do hospedeiro, macrófagos e plaquetas. A resposta é caracterizada por um infiltrado inflamatório composto principalmente de macrófagos e células natural killer (com pequeno número de células T ), trombose intravascular e necrose fibrinoide das paredes dos vasos.
A ligação dos XNAs anteriormente mencionados ao endotélio do doador leva à ativação de macrófagos hospedeiros, bem como do próprio endotélio. A ativação do endotélio é considerada tipo II, uma vez que a indução gênica e a síntese protéica estão envolvidas. A ligação de XNAs leva ao desenvolvimento de um estado pró-coagulante, a secreção de citocinas inflamatórias e quimiocinas , bem como a expressão de moléculas de adesão de leucócitos, como E-selectina , molécula de adesão intercelular-1 ( ICAM-1 ) e célula vascular molécula de adesão-1 ( VCAM-1 ).
Esta resposta é ainda perpetuada como normalmente a ligação entre proteínas reguladoras e seus ligantes ajuda no controle da coagulação e respostas inflamatórias. No entanto, devido a incompatibilidades moleculares entre as moléculas da espécie doadora e do receptor (como as moléculas do complexo principal de histocompatibilidade suína e as células matadoras naturais humanas), isso pode não ocorrer.
Superando a rejeição vascular aguda
Devido à sua complexidade, o uso de drogas imunossupressoras juntamente com uma ampla gama de abordagens são necessárias para prevenir a rejeição vascular aguda e incluem a administração de um inibidor de trombina sintético para modular a trombogênese, depleção de anticorpos anti-galactose (XNAs) por técnicas como imunoadsorção , para prevenir a ativação de células endoteliais e inibir a ativação de macrófagos (estimulados por células T CD4 + ) e células NK (estimulados pela liberação de Il-2). Assim, o papel das moléculas de MHC e das respostas das células T na ativação teria que ser reavaliado para cada combinação de espécies.
Alojamento
Se a rejeição vascular hiperaguda e aguda for evitada, a acomodação é possível, que é a sobrevivência do xenoenxerto apesar da presença de XNAs circulantes. O enxerto é liberado da rejeição humoral quando a cascata do complemento é interrompida, os anticorpos circulantes são removidos ou sua função é alterada, ou quando ocorre uma alteração na expressão de antígenos de superfície no enxerto. Isso permite que o xenoenxerto regule positivamente e expresse genes protetores, que auxiliam na resistência a lesões, como o heme oxigenase-1 (uma enzima que catalisa a degradação do heme).
Rejeição celular
A rejeição do xenoenxerto na rejeição vascular hiperaguda e aguda deve-se à resposta do sistema imune humoral , uma vez que a resposta é eliciada pelos XNAs. A rejeição celular é baseada na imunidade celular e é mediada por células natural killer que se acumulam e danificam o xenoenxerto e os linfócitos T que são ativados por moléculas de MHC por meio de xenorreconhecimento direto e indireto.
No xenorreconhecimento direto, as células apresentadoras de antígenos do xenoenxerto apresentam peptídeos às células T CD4 + receptoras por meio de moléculas de MHC de classe II xenogênicas, resultando na produção de interleucina 2 (IL-2). O xenorreconhecimento indireto envolve a apresentação de antígenos do xenoenxerto pelas células apresentadoras de antígenos receptoras às células T CD4 + . Os antígenos de células de enxerto fagocitadas também podem ser apresentados pelas moléculas de MHC de classe I do hospedeiro às células T CD8 + .
A força da rejeição celular em xenoenxertos permanece incerta, no entanto, espera-se que seja mais forte do que em aloenxertos devido às diferenças nos peptídeos entre diferentes animais. Isso leva a mais antígenos potencialmente reconhecidos como estranhos, provocando assim uma maior resposta xenogênica indireta.
Superando a rejeição do celular
Uma estratégia proposta para evitar a rejeição celular é induzir a não responsividade do doador usando quimerismo hematopoiético. As células-tronco do doador são introduzidas na medula óssea do receptor, onde coexistem com as células-tronco do receptor. As células-tronco da medula óssea dão origem a células de todas as linhagens hematopoiéticas, por meio do processo de hematopoiese . As células progenitoras linfóides são criadas por esse processo e se movem para o timo, onde a seleção negativa elimina as células T que são reativas a si mesmas. A existência de células-tronco do doador na medula óssea do receptor faz com que as células T reativas do doador sejam consideradas próprias e apoptose .
Rejeição crônica
A rejeição crônica é lenta e progressiva e geralmente ocorre em transplantes que sobrevivem às fases iniciais de rejeição. Os cientistas ainda não estão certos de como a rejeição crônica funciona exatamente, a pesquisa nesta área é difícil, uma vez que os xenoenxertos raramente sobrevivem após as fases iniciais de rejeição aguda. No entanto, sabe-se que os XNAs e o sistema complemento não estão envolvidos principalmente. A fibrose no xenoenxerto ocorre como resultado de reações imunológicas, citocinas (que estimulam os fibroblastos) ou cicatrização (após necrose celular na rejeição aguda). Talvez a principal causa da rejeição crônica seja a arteriosclerose . Os linfócitos, previamente ativados por antígenos na parede do vaso do enxerto, ativam os macrófagos para secretar fatores de crescimento do músculo liso. Isso resulta em um acúmulo de células musculares lisas nas paredes dos vasos, causando o endurecimento e estreitamento dos vasos dentro do enxerto. A rejeição crônica leva a alterações patológicas do órgão, e é por isso que os transplantes devem ser substituídos após tantos anos. Também se prevê que a rejeição crônica será mais agressiva em xenotransplantes do que em alotransplantes.
Coagulação desregulada
Esforços bem-sucedidos têm sido feitos para criar ratos knockout sem α1,3GT; a redução resultante no epítopo αGal altamente imunogênico resultou na redução da ocorrência de rejeição hiperaguda, mas não eliminou outras barreiras ao xenotransplante, como a coagulação desregulada, também conhecida como coagulopatia .
Diferentes xenotransplantes de órgãos resultam em diferentes respostas na coagulação. Por exemplo, os transplantes renais resultam em um grau mais alto de coagulopatia , ou coagulação prejudicada, do que os transplantes cardíacos, enquanto os xenoenxertos de fígado resultam em trombocitopenia grave , causando a morte do receptor em alguns dias devido ao sangramento. Um distúrbio de coagulação alternativo, a trombose , pode ser iniciado por anticorpos preexistentes que afetam o sistema anticoagulante da proteína C. Devido a esse efeito, os doadores suínos devem ser examinados extensivamente antes do transplante. Estudos também mostraram que algumas células de transplante de suínos são capazes de induzir a expressão de fator de tecido humano, estimulando a agregação de plaquetas e monócitos ao redor do órgão xenotransplantado, causando coagulação severa. Além disso, o acúmulo espontâneo de plaquetas pode ser causado pelo contato com o fator de von Willebrand de porco.
Assim como o epítopo α1,3G é um grande problema no xenotransplante, a coagulação desregulada também é uma causa de preocupação. Porcos transgênicos que podem controlar a atividade coagulante variável com base no órgão específico transplantado tornaria o xenotransplante uma solução mais prontamente disponível para os 70.000 pacientes por ano que não recebem uma doação humana do órgão ou tecido de que precisam.
Fisiologia
É necessária uma extensa pesquisa para determinar se os órgãos dos animais podem substituir as funções fisiológicas dos órgãos humanos. Muitos problemas incluem tamanho - diferenças no tamanho dos órgãos limitam a gama de recipientes potenciais de xenotransplantes; longevidade - A expectativa de vida da maioria dos porcos é de aproximadamente 15 anos, atualmente não se sabe se um xenoenxerto pode ou não ser capaz de durar mais do que isso; diferenças hormonais e proteicas - algumas proteínas são molecularmente incompatíveis, o que pode causar o mau funcionamento de processos regulatórios importantes. Essas diferenças também tornam a perspectiva do xenotransplante hepático menos promissora, uma vez que o fígado desempenha um papel importante na produção de tantas proteínas; ambiente - por exemplo, corações de porco trabalham em um local anatômico diferente e sob pressão hidrostática diferente do que em humanos; temperatura - a temperatura corporal dos suínos é de 39 ° C (2 ° C acima da temperatura média do corpo humano). As implicações desta diferença, se houver, na atividade de enzimas importantes são atualmente desconhecidas.
Xenozoonose
A xenozoonose, também conhecida como zoonose ou xenose, é a transmissão de agentes infecciosos entre espécies via xenoenxerto. A infecção de animais para humanos é normalmente rara, mas já ocorreu no passado. Um exemplo disso é a gripe aviária , quando um vírus influenza A foi transmitido de pássaros para humanos. O xenotransplante pode aumentar a chance de transmissão de doenças por 3 razões: (1) a implantação rompe a barreira física que normalmente ajuda a prevenir a transmissão de doenças, (2) o receptor do transplante ficará gravemente imunossuprimido e (3) reguladores do complemento humano (CD46 , CD55 e CD59) expressos em porcos transgênicos têm demonstrado servir como receptores de vírus e também podem ajudar a proteger os vírus do ataque do sistema complemento.
Exemplos de vírus transportados por porcos incluem herpesvírus suíno , rotavírus , parvovírus e circovírus . Os herpesvírus e rotavírus suínos podem ser eliminados do pool de doadores por meio de triagem; no entanto, outros (como parvovírus e circovírus) podem contaminar alimentos e calçados e, em seguida, reinfectar o rebanho. Portanto, os porcos para serem usados como doadores de órgãos devem ser alojados sob regulamentações estritas e rastreados regularmente para micróbios e patógenos. Vírus desconhecidos, assim como aqueles que não são prejudiciais ao animal, também podem representar riscos. De particular preocupação são os PERVS (retrovírus endógenos suínos), micróbios transmitidos verticalmente que se incorporam aos genomas suínos. Os riscos da xenose são duplos, pois não apenas o indivíduo pode ser infectado, mas uma nova infecção pode iniciar uma epidemia na população humana. Por causa desse risco, o FDA sugeriu que todos os receptores de xenotransplantes devem ser monitorados de perto pelo resto de suas vidas e colocados em quarentena se mostrarem sinais de xenose.
Babuínos e porcos carregam uma miríade de agentes transmissíveis que são inofensivos em seu hospedeiro natural, mas extremamente tóxicos e mortais em humanos. O HIV é um exemplo de doença que se acredita ter passado dos macacos aos humanos. Os pesquisadores também não sabem se um surto de doenças infecciosas poderia ocorrer e se eles poderiam conter o surto, embora tenham medidas de controle. Outro obstáculo que os xenotransplantes enfrentam é a rejeição do corpo a objetos estranhos por seu sistema imunológico. Esses antígenos (objetos estranhos) são frequentemente tratados com drogas imunossupressoras poderosas que podem, por sua vez, tornar o paciente vulnerável a outras infecções e realmente ajudar na doença. Esse é o motivo pelo qual os órgãos teriam que ser alterados para se adequar ao DNA dos pacientes ( histocompatibilidade ).
Em 2005, o Conselho Nacional de Saúde e Pesquisa Médica da Austrália (NHMRC) declarou uma moratória de dezoito anos sobre todos os transplantes de animais para humanos, concluindo que os riscos de transmissão de vírus animais aos pacientes e à comunidade em geral não foram resolvidos. Isso foi revogado em 2009 depois que uma revisão do NHMRC declarou "... os riscos, se devidamente regulamentados, são mínimos e aceitáveis, dados os benefícios potenciais.", Citando desenvolvimentos internacionais sobre a gestão e regulamentação do xenotransplante pela Organização Mundial da Saúde e pela Europa Agência de medicamentos.
Retrovírus endógenos suínos
Retrovírus endógenos são remanescentes de infecções virais antigas, encontrados nos genomas da maioria, senão de todas as espécies de mamíferos. Integrados ao DNA cromossômico, eles são transferidos verticalmente por herança. Devido às muitas deleções e mutações que eles acumulam ao longo do tempo, eles geralmente não são infecciosos na espécie hospedeira; no entanto, o vírus pode se tornar infeccioso em outra espécie. PERVS foram originalmente descobertos como partículas de retrovírus liberadas de células renais de suínos em cultura. A maioria das raças de suínos possui aproximadamente 50 genomas PERV em seu DNA. Embora seja provável que a maioria deles seja defeituosa, alguns podem ser capazes de produzir vírus infecciosos, portanto, cada genoma proviral deve ser sequenciado para identificar quais representam uma ameaça. Além disso, por meio de complementação e recombinação genética, dois genomas de PERV defeituosos podem dar origem a um vírus infeccioso. Existem três subgrupos de PERVs infecciosos (PERV-A, PERV-B e PERV-C). Experimentos mostraram que PERV-A e PERV-B podem infectar células humanas em cultura. Até o momento, nenhum xenotransplante experimental demonstrou a transmissão de PERV, mas isso não significa que as infecções de PERV em humanos sejam impossíveis. As células de porco foram projetadas para inativar todos os 62 PERVs no genoma usando a tecnologia de edição de genoma CRISPR Cas9 e eliminou a infecção do porco para as células humanas em cultura.
Ética
Os xenoenxertos têm sido um procedimento controverso desde a primeira tentativa. Muitos, incluindo grupos de direitos dos animais, se opõem fortemente a matar animais para colher seus órgãos para uso humano. Na década de 1960, muitos órgãos vieram dos chimpanzés e foram transferidos para pessoas que estavam mortalmente doentes e, por sua vez, não viveram muito depois disso. Apoiadores científicos modernos do xenotransplante argumentam que os benefícios potenciais para a sociedade superam os riscos, tornando a busca do xenotransplante a escolha moral. Nenhuma das principais religiões se opõe ao uso de órgãos geneticamente modificados de suínos para transplantes que salvam vidas. Religiões como o budismo e o jainismo , entretanto, há muito defendem a não violência contra todas as criaturas vivas. Em geral, o uso de tecido de porco e vaca em humanos encontrou pouca resistência, exceto algumas crenças religiosas e algumas objeções filosóficas. As doutrinas de experimentação sem consentimento são agora seguidas, o que não acontecia no passado, o que pode levar a novas diretrizes religiosas para pesquisas médicas adicionais sobre diretrizes ecumênicas pronunciadas. A "Regra Comum" é o mandato de bioética dos Estados Unidos em 2011.
História do Xenotransplante na Ética
No início do século 20, quando os estudos em xenotransplante estavam apenas começando, poucos questionavam a moralidade do mesmo, voltando-se para os animais como uma alternativa "natural" aos aloenxertos . Enquanto peças satíricas zombavam de xenoenxertos como Serge Voronoff , e algumas imagens mostrando primatas emocionalmente perturbados apareciam - que Voronoff havia privado de seus testículos - nenhuma tentativa séria foi feita para questionar a ciência com base nas preocupações com os direitos dos animais. O xenotransplante não foi levado a sério, pelo menos na França, durante a primeira metade do século XX.
Com o incidente Baby Fae de 1984 como o ímpeto, ativistas dos direitos dos animais começaram a protestar, atraindo a atenção da mídia e provando que algumas pessoas achavam que era antiético e uma violação dos próprios direitos do animal usar seus órgãos para preservar a vida de um ser humano doente. Tratar os animais como meras ferramentas para o abate sob demanda da vontade humana levaria a um mundo que eles não prefeririam. Os defensores do transplante recuaram, alegando que salvar uma vida humana justifica o sacrifício de uma vida animal. A maioria dos ativistas dos direitos dos animais considerou o uso de órgãos de primatas mais repreensível do que, por exemplo, porcos. Como Peter Singer et al. expressaram, muitos primatas exibem maior estrutura social, habilidades de comunicação e afeto do que humanos com deficiência mental e bebês humanos. Apesar disso, é consideravelmente improvável que o sofrimento dos animais forneça ímpeto suficiente para que os reguladores evitem o xenotransplante.
Consentimento informado do paciente
Autonomia e consentimento informado são importantes ao considerar os usos futuros do xenotransplante. Um paciente submetido a xenotransplante deve estar totalmente ciente do procedimento e não deve ter nenhuma força externa influenciando sua escolha. O paciente deve compreender os riscos e benefícios de tal transplante. No entanto, tem sido sugerido que amigos e familiares também devem dar consentimento, pois as repercussões do transplante são altas, com o potencial de doenças e vírus passando para humanos a partir do transplante. Contatos próximos correm o risco de tais infecções. O monitoramento de parentes próximos também pode ser necessário para garantir que a xenozoonose não esteja ocorrendo. A questão então é: a autonomia do paciente torna-se limitada com base na vontade ou não de amigos e familiares em dar consentimento, e os princípios de confidencialidade são quebrados?
A segurança da saúde pública é um fator a ser considerado. Se houver algum risco para o público de um surto de transplante, devem haver procedimentos para proteger o público. Não apenas o receptor do transplante deve compreender os riscos e benefícios, mas a sociedade também deve compreender e consentir com tal acordo.
O Comitê de Ética da Associação Internacional de Xenotransplantes aponta que uma das principais questões éticas é a resposta da sociedade a tal procedimento. A suposição é que o receptor do transplante será solicitado a passar por monitoramento vitalício, o que negaria ao receptor a capacidade de encerrar o monitoramento a qualquer momento, o que está em oposição direta à Declaração de Helsinque e ao Código de Regulamentações Federais dos EUA . Em 2007, o xenotransplante foi proibido por motivos éticos em todos os países, exceto Argentina, Rússia e Nova Zelândia. Desde então, a prática só foi realizada para o tratamento do diabetes tipo 1 para servir como substituto das injeções de insulina.
A aplicação dos quatro princípios da bioética é encontrada em toda parte, porque agora é padronizada nas condutas morais de um laboratório. Os quatro princípios enfatizam o consentimento informado, o juramento hipocrático de não causar danos, aplicar a habilidade de uma pessoa para ajudar os outros e proteger os direitos dos outros a um atendimento de qualidade.
O problema do xenotransplante é que, embora tenha benefícios médicos futuros, também apresenta o sério risco de introdução e disseminação de doenças infecciosas na população humana. Existem diretrizes que foram elaboradas pelo governo com o objetivo de formar a base da vigilância de doenças infecciosas. No Reino Unido , a diretriz introduzida afirma que, primeiro, "o fornecimento periódico de amostras corporais que seriam arquivadas para fins epidemiológicos"; segundo, "análise post-mortem em caso de morte, o armazenamento de amostras post-mortem e a divulgação deste acordo para sua família;" terceiro, "evite doar sangue, tecido ou órgãos"; quarto, "o uso de contracepção de barreira ao se envolver em relações sexuais"; quinto, manter o nome e o endereço atual registrados e notificar as autoridades de saúde relevantes quando se mudar para o exterior; "e, por último," divulgar informações confidenciais, incluindo o status de um receptor de xenotransplante para pesquisadores, todos os profissionais de saúde de quem se procura serviços profissionais, e contatos próximos, como parceiros sexuais atuais e futuros. "Com essas diretrizes em vigor, o paciente deve cumprir essas regras até a vida ou até que o governo determine que não há necessidade de guardas de segurança de saúde pública.
Diretrizes de xenotransplante nos Estados Unidos
A Food and Drug Administration ( FDA ) também declarou que, se ocorrer um transplante, o receptor deve ser monitorado pelo resto da vida do receptor e renunciar ao seu direito de retirada. A razão para a necessidade de monitoramento por toda a vida é devido ao risco de infecções agudas que podem ocorrer. O FDA sugere que um programa de rastreamento passivo deve ser implementado e deve se estender por toda a vida do receptor.
Veja também
- Aloenxerto
- Isoenxerto
- Enxerto médico
- Monstro de Frankenstein - personagem fictício criado por Mary Shelley
- Cyborg
- Híbrido (biologia) - Descendência da reprodução entre espécies
- Transferência horizontal de genes - Tipo de mudança genética não hereditária envolvendo troca de DNA ou RNA diferente de pai para filho
- Xenogravura
Referências
links externos
- PBS especial em transplantes de porco para humanos
- Campanha pelo Transplante Responsável
- Declaração de 2005 do Conselho Nacional de Saúde e Pesquisa Médica da Austrália sobre xenotransplante
- Fan, Shelly (12 de junho de 2016). "O crescimento de órgãos humanos em porcos pode resolver a escassez de órgãos?" . Singularity Hub .