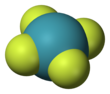
Tetrafluoreto de xenônio - Xenon tetrafluoride

|
|||
|
|
|||
| Nomes | |||
|---|---|---|---|
|
Nome IUPAC
Tetrafluoreto de xenônio
|
|||
| Identificadores | |||
|
Modelo 3D ( JSmol )
|
|||
| ChemSpider | |||
| ECHA InfoCard |
100.033.858 |
||
|
PubChem CID
|
|||
| UNII | |||
|
Painel CompTox ( EPA )
|
|||
|
|||
|
|||
| Propriedades | |||
|
XeF 4 |
|||
| Massa molar | 207,2836 g mol −1 | ||
| Aparência | Sólido branco | ||
| Densidade | 4,040 g cm -3 , sólido | ||
| Ponto de fusão | 117 ° C (243 ° F; 390 K) sublimes | ||
| Reage | |||
| Estrutura | |||
| D 4h | |||
| planar quadrado | |||
| 0 D | |||
| Termoquímica | |||
|
Entropia molar padrão ( S |
146 J · mol −1 · K −1 | ||
| −251 kJ · mol −1 | |||
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|||
|
|
|||
| Referências da Infobox | |||
O tetrafluoreto de xenônio é um composto químico com a fórmula química XeF
4. Foi o primeiro composto binário descoberto de um gás nobre . É produzido pela reação química do xenônio com o flúor , F
2, de acordo com a equação química :
- Xe + 2 F
2→ XeF
4
Essa reação é exotérmica , liberando uma energia de 251 kJ / mol.
O tetrafluoreto de xenônio é uma substância cristalina incolor . Sua estrutura foi determinada por espectroscopia de RMN e cristalografia de raios-X em 1963. A estrutura é quadrada planar , como foi confirmado por estudos de difração de nêutrons . De acordo com a teoria VSEPR , além de quatro ligantes de fluoreto, o centro de xenônio tem dois pares solitários de elétrons. Esses pares solitários são mutuamente trans.
Xenon tetrafluoreto sublima a uma temperatura de 115,7 ° C .
Síntese
O tetrafluoreto de xenônio é produzido pelo aquecimento de uma mistura de xenônio e flúor na proporção de 1: 5 em um recipiente de níquel a 400 ° C. Algum hexafluoreto de xenônio , XeF
6, também é produzido, e essa produção é aumentada com o aumento da concentração de flúor na mistura de entrada. O níquel não é um catalisador para essa reação; Os recipientes de níquel são usados porque reagem com o flúor para formar uma camada protetora e não descascável de fluoreto de níquel (II) NiF
2 em suas superfícies internas.
Reações
O tetrafluoreto de xenônio hidrolisa a baixas temperaturas para formar xenônio elementar, oxigênio , ácido fluorídrico e trióxido de xenônio aquoso .
A reação com fluoreto de tetrametilamônio dá pentafluoroxenato de tetrametilamônio , que contém o XeF pentagonal-
5ânion. The XeF-
5ânion também é formado pela reação com fluoreto de césio :
- CsF + XEF
4→ CsXeF
5
Reação com pentafluoreto de bismuto ( BiF
5) forma o XeF+
3 cátion:
-
BiF
5+ XeF
4→ XeF 3 BiF 6
The XeF+
3cátion no sal XeF 3 Sb 2 F 11 foi caracterizado por espectroscopia de NMR.
A 400 ° C, XeF
4reage com o xenônio para formar XeF
2:
- XeF 4 + Xe → 2 XeF 2
A reação de tetrafluoreto de xenônio com platina produz tetrafluoreto de platina e xenônio:
- XeF 4 + Pt → PtF 4 + Xe
Formulários
O tetrafluoreto de xenônio tem poucas aplicações. Foi demonstrado que degradava a borracha de silicone para analisar traços de impurezas metálicas na borracha. XeF
4 reage com o silicone para formar produtos gasosos simples, deixando um resíduo de impurezas metálicas.