Xilose isomerase - Xylose isomerase
| xilose isomerase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Tetrâmero de D-xilose isomerase de Streptomyces rubiginosus PDB 2glk . Um monômero é colorido por uma estrutura secundária para destacar a arquitetura do barril TIM.
| |||||||||
| Identificadores | |||||||||
| EC nº | 5.3.1.5 | ||||||||
| CAS no. | 9023-82-9 | ||||||||
| Bancos de dados | |||||||||
| IntEnz | Vista IntEnz | ||||||||
| BRENDA | Entrada BRENDA | ||||||||
| ExPASy | NiceZyme view | ||||||||
| KEGG | Entrada KEGG | ||||||||
| MetaCyc | via metabólica | ||||||||
| PRIAM | perfil | ||||||||
| Estruturas PDB | RCSB PDB PDBe PDBsum | ||||||||
| Ontologia Genética | AmiGO / QuickGO | ||||||||
| |||||||||
Em enzimologia , uma xilose isomerase ( EC 5.3.1.5 ) é uma enzima que catalisa a interconversão de D-xilose e D-xilulose . Esta enzima pertence à família das isomerases , especificamente aquelas oxidoredutases intramoleculares que interconvertem aldoses e cetoses . A isomerase já foi observada em quase uma centena de espécies de bactérias. As xilose -isomerases também são comumente chamadas de frutose-isomerases devido à sua capacidade de interconverter glicose e frutose. O nome sistemático desta classe de enzimas é D-xilose aldose-cetose-isomerase. Outros nomes de uso comum incluem D-xilose isomerase, D-xilose cetoisomerase e D-xilose cetol-isomerase.
História
A atividade da D-xilose isomerase foi observada pela primeira vez por Mitsuhashi e Lampen em 1953 na bactéria Lactobacillus pentosus . A produção artificial por meio de E. coli transformada também teve sucesso. Em 1957, a atividade da D-xilose isomerase na conversão da D-glicose em D-frutose foi observada por Kooi e Marshall. Sabe-se agora que as isomerases têm ampla especificidade de substrato. A maioria das pentoses e algumas hexoses são substratos para a D-xilose isomerase. Alguns exemplos incluem: D-ribose, L-arabinose, L-ramnose e D-alose.
A conversão de glicose em frutose pela xilose isomerase foi patenteada pela primeira vez na década de 1960, no entanto, o processo não era industrialmente viável porque as enzimas estavam suspensas em solução e a reciclagem da enzima era problemática. Uma xilose isomerase imóvel que foi fixada em uma superfície sólida foi desenvolvida pela primeira vez no Japão por Takanashi. Esses desenvolvimentos foram essenciais para o desenvolvimento de processos de fermentação industrial usados na fabricação de xarope de milho com alto teor de frutose .
A estrutura terciária foi determinada para várias xilose isomerases de micróbios a partir de meados de 1980 ( Streptomyces olivochromogenes em 1988, Streptomyces violaceoniger em 1988, Streptomyces rubiginosus em 1984, Arthrobacter B3728 em 1986, Actinoplanes missouriensis em 1992 e Clostridium thermosulfurogenes em 1990).
Função
Esta enzima participa em pentoses e interconversões glucuronato e frutose e manose metabolismo. Os açúcares mais biodisponíveis de acordo com a Sociedade Internacional de Açúcares Raros são: glicose, galactose, manose, frutose, xilose, ribose e L-arabinose. Vinte hexoses e nove pentoses, incluindo a xilulose, foram consideradas "açúcares raros". Conseqüentemente, a D-xilose isomerase é usada para produzir esses açúcares raros que têm aplicações muito importantes na biologia, apesar de sua baixa abundância.
Caracterização
A xilose isomerase que pode ser isolada do vinho de arroz chinês vermelho, que contém a bactéria Lactobacillus xylosus . Esta bactéria foi erroneamente classificada como L. plantarum , que normalmente cresce no açúcar L-arabinose , e raramente cresce na D-xilose. L. xylosus foi reconhecido como distinto por sua capacidade de crescer em D-xilose. A xilose isomerase em L. xylosus tem um peso molecular de cerca de 183.000 Daltons. Seu pH ótimo de crescimento é de cerca de 7,5 para L. lactis , entretanto cepas como a enzima xilose L.brevis preferem um ambiente mais alcalino. A cepa de L. lactis é estável na faixa de pH de 6,5 a 11,0, e a enzima L. brevis , que é menos tolerante a mudanças de pH, mostra atividade na faixa de pH de 5,7-7,0. Testes térmicos também foram feitos por Kei Y. e Noritaka T. e a xilose isomerase foi considerada termicamente estável a cerca de 60 graus Celsius
Site e mecanismo ativos
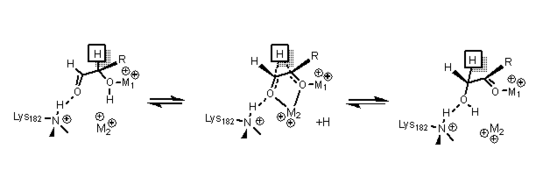
A xilose isomerase tem uma estrutura baseada em oito barris alfa / beta que criam um sítio ativo contendo dois íons de magnésio divalentes. As enzimas xilose isomerase exibem uma dobra em barril TIM com o sítio ativo no centro do barril e uma estrutura quaternária tetramérica . As estruturas do PDB estão disponíveis nos links da infobox à direita. A proteína é um tetrâmero em que os barris emparelhados são quase coaxiais, que formam duas cavidades nas quais os metais divalentes estão ligados a uma das duas cavidades. Os metais estão em uma geometria octaédrica. O local metálico 1 liga o substrato firmemente, enquanto o local metálico dois liga o substrato fracamente. Ambos compartilham um resíduo ácido O ácido glutâmico 216 da enzima que faz a ponte entre os dois cátions. Dois aminoácidos básicos circundam os ligantes carregados negativos para neutralizá-los. A segunda cavidade está voltada para a cavidade de metal e ambas as cavidades compartilham a mesma rota de acesso. A segunda cavidade é de natureza hidrofóbica e possui um importante resíduo de histidina que é ativado por um resíduo de aspartato que é ligado a ela por hidrogênio . Este resíduo de histidina é importante na isomerização da glicose.
Na isomerização da glicose, a histidina 53 é usada para catalisar a transferência de prótons de O1 para O5; o diagrama para o mecanismo de abertura do anel é mostrado abaixo. O primeiro metal, mencionado anteriormente, coordena-se com O3 e O4 e é usado para encaixar o substrato.
Na isomerização da xilose, dados de cristal mostraram que o açúcar xilose se liga à enzima em uma conformação de cadeia aberta . O metal 1 se liga ao O2 e O4 e, uma vez ligado, o metal 2 se liga ao O1 e ao O2 no estado de transição, e essas interações junto com um resíduo de lisina ajudam a catalisar a mudança de hidreto necessária para a isomerização. O estado de transição consiste em um íon de carbono de alta energia que é estabilizado por meio de todas as interações do metal com o substrato de açúcar.
Aplicação na indústria
A aplicação mais amplamente usada desta enzima é na conversão de glicose em frutose para produzir xarope de milho com alto teor de frutose (HFCS). Existem três etapas gerais na produção de HFCS a partir do amido:
- degradação enzimática do amido usando α- amilase . Também conhecido como liquificação.
- degradação adicional usando glucoamilase e uma enzima de desramificação.
- Produção de frutose por meio da xilose isomerase
O processo é realizado em biorreatores a 60–65 ° C. As enzimas tornam-se inativadas em altas temperaturas como essa, e um dos focos da pesquisa tem sido a engenharia de versões mais termoestáveis da xilose isomerase e das outras enzimas do processo. As enzimas são geralmente imobilizadas para aumentar o rendimento; maneiras melhores de fazer isso tem sido outro foco de pesquisa.
A xilose isomerase é uma das enzimas utilizadas pelas bactérias na natureza para usar a celulose como alimento e outro foco na pesquisa industrial e acadêmica, vem desenvolvendo versões da xilose isomerase que podem ser úteis na produção de biocombustíveis .
Como suplemento dietético
Os produtos que contêm xilose-isomerase são vendidos como suplementos dietéticos de venda livre para combater a má absorção de frutose , principalmente na Europa e sob nomes de marcas incluindo Fructaid , Fructease e Fructosin . Além das preocupações gerais sobre a eficácia das enzimas OTC, atualmente há pesquisas muito limitadas disponíveis sobre a Xilose-Isomerase como um suplemento dietético, com o único estudo científico indicando um efeito positivo na náusea relacionada à má absorção e na dor abdominal, mas nenhum no inchaço .
Referências
Leitura adicional
- Hochster RM, Watson RW (1954). "Enzymatic isomerization of D-xylose to D-xylulose". Arco. Biochem. Biophys . 48 (1): 120–9. doi : 10.1016 / 0003-9861 (54) 90313-6 . PMID 13125579 .
- Slein MW (1955). "Xilose isomerase de Pasteurella pestis, cepa A-1122". Geléia. Chem. Soc . 77 (6): 1663–1667. doi : 10.1021 / ja01611a074 .
- Yamanaka K (1968). "Purificação, cristalização e propriedades da D-xilose isomerase de Lactobacillus brevis". Biochim. Biophys. Acta . 151 (3): 670–80. doi : 10.1016 / 0005-2744 (68) 90015-6 . PMID 5646045 .