Óxido de zinco - Zinc oxide

|
|
| Nomes | |
|---|---|
| Outros nomes
Branco de zinco, calamina, lã filosofal, branco chinês, flores de zinco
|
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard |
100.013.839 |
| Número EC | |
| 13738 | |
| KEGG | |
|
PubChem CID
|
|
| Número RTECS | |
| UNII | |
| Número ONU | 3077 |
|
Painel CompTox ( EPA )
|
|
|
|
|
|
| Propriedades | |
| Zn O | |
| Massa molar | 81,406 g / mol |
| Aparência | Sólido branco |
| Odor | Inodoro |
| Densidade | 5,606 g / cm 3 |
| Ponto de fusão | 1.974 ° C (3.585 ° F; 2.247 K) (decompõe-se) |
| Ponto de ebulição | 1.974 ° C (3.585 ° F; 2.247 K) (decompõe-se) |
| 0,0004% (17,8 ° C) | |
| Gap de banda | 3,3 eV ( direto ) |
| −27,2 · 10 −6 cm 3 / mol | |
|
Índice de refração ( n D )
|
n 1 = 2,013, n 2 = 2,029 |
| Estrutura | |
| Wurtzite | |
| C 6v 4 - P 6 3 mc | |
|
a = 3,2495 Å, c = 5,2069 Å
|
|
|
Unidades de fórmula ( Z )
|
2 |
| Tetraédrico | |
| Termoquímica | |
|
Capacidade de calor ( C )
|
40,3 J · K −1 mol −1 |
|
Entropia molar padrão ( S |
43,7 ± 0,4 J · K −1 mol −1 |
| -350,5 ± 0,3 kJ mol −1 | |
|
Energia livre de Gibbs (Δ f G ˚)
|
-320,5 kJ mol −1 |
| Farmacologia | |
| QA07XA91 ( OMS ) | |
| Perigos | |
| Ficha de dados de segurança | ICSC 0208 |
| Pictogramas GHS |

|
| Palavra-sinal GHS | Aviso |
| H400 , H401 | |
| P273 , P391 , P501 | |
| NFPA 704 (diamante de fogo) | |
| Ponto de inflamação | 1.436 ° C (2.617 ° F; 1.709 K) |
| Dose ou concentração letal (LD, LC): | |
|
LD 50 ( dose mediana )
|
240 mg / kg (intraperitoneal, rato) 7950 mg / kg (rato, oral) |
|
LC 50 ( concentração média )
|
2500 mg / m 3 (rato) |
|
LC Lo (o mais baixo publicado )
|
2500 mg / m 3 (cobaia, 3-4 h) |
| NIOSH (limites de exposição à saúde dos EUA): | |
|
PEL (permitido)
|
TWA 5 mg / m 3 (fumaça) TWA 15 mg / m 3 (poeira total) TWA 5 mg / m 3 (poeira resp) |
|
REL (recomendado)
|
Poeira: TWA 5 mg / m 3 C 15 mg / m 3 Fumaça: TWA 5 mg / m 3 ST 10 mg / m 3 |
|
IDLH (perigo imediato)
|
500 mg / m 3 |
| Compostos relacionados | |
|
Outros ânions
|
Sulfeto de zinco Seleneto de zinco Telureto de zinco |
|
Outros cátions
|
Óxido de cádmio Óxido de mercúrio (II) |
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Referências da Infobox | |
O óxido de zinco é um composto inorgânico com a fórmula Zn ó . O ZnO é um pó branco insolúvel em água. É usado como aditivo em vários materiais e produtos, incluindo cosméticos, suplementos alimentares, borrachas, plásticos, cerâmicas, vidro, cimento, lubrificantes, tintas, pomadas, adesivos, selantes, pigmentos, alimentos , baterias, ferrites, retardadores de fogo e primeiros -disse fitas. Embora ocorra naturalmente como o mineral zincita , a maior parte do óxido de zinco é produzida sinteticamente.
ZnO é um semicondutor de gap de banda larga do grupo de semicondutores II-VI . O doping nativo do semicondutor devido a vacâncias de oxigênio ou intersticiais de zinco é do tipo n. Outras propriedades favoráveis incluem boa transparência, alta mobilidade de elétrons , amplo gap de banda e forte luminescência à temperatura ambiente . Essas propriedades tornam o ZnO valioso para uma variedade de aplicações emergentes: eletrodos transparentes em telas de cristal líquido , janelas que economizam energia ou protegem o calor e eletrônicos como transistores de filme fino e diodos emissores de luz .
Propriedades quimicas
O ZnO puro é um pó branco, mas na natureza ocorre como o raro mineral zincita , que geralmente contém manganês e outras impurezas que conferem uma cor amarela a vermelha.
O óxido de zinco cristalino é termocrômico , mudando de branco para amarelo quando aquecido ao ar e revertendo para branco no resfriamento. Essa mudança de cor é causada por uma pequena perda de oxigênio para o ambiente em altas temperaturas para formar o Zn 1 + x O não estequiométrico , onde a 800 ° C, x = 0,00007.
O óxido de zinco é um óxido anfotérico . É quase insolúvel em água, mas se dissolve na maioria dos ácidos , como o ácido clorídrico :
- ZnO + 2 HCl → ZnCl 2 + H 2 O
O óxido de zinco sólido também se dissolve em álcalis para dar zincatos solúveis:
- ZnO + 2 NaOH + H 2 O → Na 2 [Zn (OH) 4 ]
ZnO reage lentamente com ácidos graxos em óleos para produzir os carboxilatos correspondentes , como oleato ou estearato . O ZnO forma produtos semelhantes ao cimento quando misturado com uma solução aquosa forte de cloreto de zinco e estes são melhor descritos como cloretos de hidróxi de zinco. Este cimento foi usado em odontologia.
O ZnO também forma material semelhante ao cimento quando tratado com ácido fosfórico ; materiais relacionados são usados na odontologia. Um dos principais componentes do cimento de fosfato de zinco produzido por essa reação é a esperançaita , Zn 3 (PO 4 ) 2 · 4H 2 O.
O ZnO se decompõe em vapor de zinco e oxigênio por volta de 1975 ° C com uma pressão de oxigênio padrão. Em uma reação carbotérmica , o aquecimento com carbono converte o óxido em vapor de zinco a uma temperatura muito mais baixa (cerca de 950 ° C).
- ZnO + C → Zn (Vapor) + CO
Propriedades físicas
Estrutura
O óxido de zinco cristaliza em duas principais formas , hexagonal wurtzite e cúbico zincblende . A estrutura wurtzite é mais estável em condições ambientais e, portanto, mais comum. A forma de zincblenda pode ser estabilizada pelo crescimento de ZnO em substratos com estrutura de rede cúbica. Em ambos os casos, os centros de zinco e óxido são tetraédricos , a geometria mais característica para Zn (II). O ZnO se converte no motivo de sal rochoso a pressões relativamente altas de cerca de 10 GPa. As muitas propriedades médicas notáveis dos cremes contendo ZnO podem ser explicadas por sua suavidade elástica, que é característica de compostos binários coordenados tetraédricos próximos à transição para estruturas octaédricas.
Os polimorfos hexagonais e de zincblenda não têm simetria de inversão (a reflexão de um cristal em relação a qualquer ponto não o transforma em si mesmo). Esta e outras propriedades de simetria de rede resultam em piezoeletricidade do ZnO hexagonal e zincblende, e piroeletricidade do ZnO hexagonal.
A estrutura hexagonal tem um grupo de pontos 6 mm ( notação Hermann-Mauguin ) ou C 6v ( notação Schoenflies ), e o grupo espacial é P6 3 mc ou C 6v 4 . As constantes de rede são a = 3,25 Å e c = 5,2 Å; sua razão c / a ~ 1,60 é próxima ao valor ideal para célula hexagonal c / a = 1,633. Como na maioria dos materiais do grupo II-VI , a ligação em ZnO é amplamente iônica (Zn 2+ –O 2− ) com os raios correspondentes de 0,074 nm para Zn 2+ e 0,140 nm para O 2− . Esta propriedade é responsável pela formação preferencial de wurtzita em vez da estrutura de blenda de zinco, bem como pela forte piezoeletricidade do ZnO. Por causa das ligações polares Zn-O, os planos de zinco e oxigênio são eletricamente carregados. Para manter a neutralidade elétrica, esses planos se reconstroem em nível atômico na maioria dos materiais relativos, mas não em ZnO - suas superfícies são atomicamente planas, estáveis e não exibem nenhuma reconstrução. No entanto, estudos usando estruturas wurtzoid explicaram a origem da planicidade da superfície e a ausência de reconstrução nas superfícies wurtzite de ZnO, além da origem das cargas nos planos de ZnO.
Propriedades mecânicas
ZnO é um material relativamente macio com dureza aproximada de 4,5 na escala de Mohs . Suas constantes elásticas são menores do que as de semicondutores III-V relevantes, como GaN . A alta capacidade de calor e condutividade de calor, baixa expansão térmica e alta temperatura de fusão do ZnO são benéficas para a cerâmica. O fônon óptico E2 em ZnO exibe uma vida útil incomumente longa de 133 ps a 10 K.
Entre os semicondutores tetraedricamente ligados, foi afirmado que ZnO tem o maior tensor piezoelétrico, ou pelo menos um comparável ao de GaN e AlN . Esta propriedade o torna um material tecnologicamente importante para muitas aplicações piezoelétricas , que requerem um grande acoplamento eletromecânico. Portanto, o ZnO tem sido em formas de filme fino um dos materiais ressonadores mais estudados para ressonadores acústicos de massa de filme fino .
Propriedades elétricas e ópticas
O ZnO tem uma lacuna de banda direta relativamente grande de ~ 3,3 eV em temperatura ambiente. As vantagens associadas a uma grande lacuna de banda incluem tensões de ruptura mais altas, capacidade de sustentar grandes campos elétricos, menor ruído eletrônico e operação em alta temperatura e alta potência. A lacuna de banda do ZnO pode ainda ser ajustada para ~ 3-4 eV por sua liga com óxido de magnésio ou óxido de cádmio .
A maior parte do ZnO tem caráter do tipo n , mesmo na ausência de doping intencional . A não estequiometria é normalmente a origem do caráter do tipo n, mas o assunto permanece controverso. Uma explicação alternativa foi proposta, com base em cálculos teóricos, de que as impurezas de hidrogênio substitutivo não intencional são responsáveis. A dopagem controlável do tipo n é facilmente alcançada substituindo Zn por elementos do grupo III, como Al, Ga, In ou substituindo oxigênio por elementos do grupo VII, cloro ou iodo .
A dopagem confiável do tipo p de ZnO permanece difícil. Este problema se origina da baixa solubilidade de dopantes do tipo p e sua compensação por abundantes impurezas do tipo n. Este problema é observado com GaN e ZnSe . A medição do tipo p em material "intrinsecamente" do tipo n é complicada pela falta de homogeneidade das amostras.
As limitações atuais ao dopagem p limitam as aplicações eletrônicas e optoeletrônicas de ZnO, que geralmente requerem junções de material tipo n e tipo p. Os dopantes do tipo p conhecidos incluem os elementos do grupo I Li, Na, K; elementos do grupo V N, P e As; bem como cobre e prata. No entanto, muitos deles formam aceptores profundos e não produzem condução significativa do tipo p à temperatura ambiente.
A mobilidade de elétrons do ZnO varia fortemente com a temperatura e tem um máximo de ~ 2000 cm 2 / (V · s) a 80 K. Os dados sobre a mobilidade do buraco são escassos com valores na faixa de 5–30 cm 2 / (V · s).
Os discos de ZnO, atuando como um varistor , são o material ativo na maioria dos pára-raios .
O óxido de zinco é conhecido por suas propriedades ópticas fortemente não lineares , especialmente a granel. A não linearidade das nanopartículas de ZnO pode ser ajustada de acordo com seu tamanho.
Produção
Para uso industrial, o ZnO é produzido em níveis de 10 5 toneladas por ano por três processos principais:
Processo indireto
No processo indireto ou francês, o zinco metálico é derretido em um cadinho de grafite e vaporizado a temperaturas acima de 907 ° C (normalmente em torno de 1000 ° C). O vapor de zinco reage com o oxigênio do ar para dar ZnO, acompanhado por uma queda em sua temperatura e luminescência brilhante. Partículas de óxido de zinco são transportadas para um duto de resfriamento e coletadas em uma casa de ensacamento. Este método indireto foi popularizado por LeClaire (França) em 1844 e, portanto, é comumente conhecido como o processo francês. Seu produto normalmente consiste em partículas aglomeradas de óxido de zinco com um tamanho médio de 0,1 a alguns micrômetros. Em peso, a maior parte do óxido de zinco do mundo é fabricado pelo processo francês.
Processo direto
O processo direto ou americano começa com diversos compostos de zinco contaminados, como minérios de zinco ou subprodutos da fundição. Os precursores de zinco são reduzidos ( redução carbotérmica ) por aquecimento com uma fonte de carbono como a antracita para produzir vapor de zinco, que é então oxidado como no processo indireto. Por causa da pureza mais baixa do material de origem, o produto final também é de qualidade inferior no processo direto em comparação com o indireto.
Processo químico úmido
Uma pequena parte da produção industrial envolve processos químicos úmidos, que começam com soluções aquosas de sais de zinco, a partir dos quais o carbonato ou hidróxido de zinco é precipitado. O precipitado sólido é então calcinado a temperaturas em torno de 800 ° C.
Síntese de Laboratório
Existem vários métodos especializados para a produção de ZnO para estudos científicos e aplicações de nicho. Esses métodos podem ser classificados pela forma de ZnO resultante (bulk, thin film, nanofio ), temperatura ("low", que está próximo à temperatura ambiente ou "high", que é T ~ 1000 ° C), tipo de processo (deposição de vapor ou crescimento da solução) e outros parâmetros.
Grandes cristais únicos (muitos centímetros cúbicos) podem crescer pelo transporte de gás (deposição em fase de vapor), síntese hidrotérmica ou crescimento por fusão. No entanto, devido à alta pressão de vapor de ZnO, o crescimento do fundido é problemático. O crescimento por transporte de gás é difícil de controlar, deixando o método hidrotérmico como preferência. Filmes finos podem ser produzidos por deposição de vapor químico , epitaxi de fase de vapor metalorgânico , eletrodeposição , deposição de laser pulsado , pulverização catódica , síntese de sol-gel , deposição de camada atômica , pirólise por spray, etc.
O óxido de zinco em pó branco comum pode ser produzido em laboratório eletrolizando uma solução de bicarbonato de sódio com um ânodo de zinco. Hidróxido de zinco e gás hidrogênio são produzidos. O hidróxido de zinco por aquecimento decompõe-se em óxido de zinco.
- Zn + 2 H 2 O → Zn (OH) 2 + H 2
- Zn (OH) 2 → ZnO + H 2 S
Nanoestruturas de ZnO
Nanoestruturas de ZnO podem ser sintetizadas em uma variedade de morfologias, incluindo nanofios, nanobastões , tetrápodes, nanofitas, nanoflores, nanopartículas etc. As nanoestruturas podem ser obtidas com a maioria das técnicas mencionadas acima, em certas condições, e também com o método vapor-líquido-sólido . A síntese é tipicamente realizada a temperaturas de cerca de 90 ° C, em uma solução aquosa equimolar de nitrato de zinco e hexamina , esta última fornecendo o ambiente básico. Certos aditivos, como polietilenoglicol ou polietilenimina, podem melhorar a razão de aspecto dos nanofios de ZnO. A dopagem dos nanofios de ZnO foi obtida adicionando-se outros nitratos de metal à solução de crescimento. A morfologia das nanoestruturas resultantes pode ser ajustada alterando os parâmetros relativos à composição do precursor (como a concentração de zinco e pH) ou ao tratamento térmico (como a temperatura e a taxa de aquecimento).
Nanofios de ZnO alinhados em substratos pré-semeados de silício , vidro e nitreto de gálio foram cultivados usando sais de zinco aquosos, como nitrato de zinco e acetato de zinco em ambientes básicos. A pré-semeadura de substratos com ZnO cria locais para a nucleação homogênea do cristal de ZnO durante a síntese. Os métodos de pré-semeadura comuns incluem decomposição térmica in-situ de cristalitos de acetato de zinco , spincoating de nanopartículas de ZnO e o uso de métodos físicos de deposição de vapor para depositar filmes finos de ZnO. A pré-semeadura pode ser realizada em conjunto com métodos de padronização de cima para baixo, como litografia de feixe de elétrons e litografia de nanosfera para designar locais de nucleação antes do crescimento. Os nanofios de ZnO alinhados podem ser usados em células solares sensibilizadas por corante e dispositivos de emissão de campo.
História
Os compostos de zinco provavelmente foram usados pelos primeiros humanos, em formas processadas e não processadas, como tinta ou pomada medicinal, mas sua composição é incerta. O uso de pushpanjan , provavelmente óxido de zinco, como bálsamo para olhos e feridas abertas, é mencionado no texto médico indiano Charaka Samhita , considerado datado de 500 aC ou antes. A pomada de óxido de zinco também é mencionada pelo médico grego Dioscórides (século I dC). Galeno sugeriu tratar os cânceres ulcerosos com óxido de zinco, como fez Avicena em seu The Canon of Medicine . É usado como ingrediente em produtos como talco para bebês e cremes contra assaduras , creme de calamina , xampus anticaspa e pomadas antissépticas .
Os romanos produziram quantidades consideráveis de latão (uma liga de zinco e cobre ) já em 200 aC por um processo de cimentação em que o cobre reagia com o óxido de zinco. Acredita-se que o óxido de zinco tenha sido produzido pelo aquecimento do minério de zinco em um forno central. Isso liberou o zinco metálico na forma de vapor, que então subiu pela chaminé e se condensou na forma de óxido. Este processo foi descrito por Dioscorides no século I DC. O óxido de zinco também foi recuperado de minas de zinco em Zawar, na Índia , que datam da segunda metade do primeiro milênio AC.
Do século 12 ao 16, o zinco e o óxido de zinco foram reconhecidos e produzidos na Índia usando uma forma primitiva do processo de síntese direta. Da Índia, a manufatura de zinco foi transferida para a China no século XVII. Em 1743, a primeira fundição de zinco europeia foi estabelecida em Bristol , no Reino Unido. Por volta de 1782, Louis-Bernard Guyton de Morveau propôs substituir o branco de chumbo pelo óxido de zinco.
O principal uso do óxido de zinco (branco de zinco) era em tintas e como aditivo para pomadas. O branco de zinco foi aceito como pigmento em pinturas a óleo em 1834, mas não se misturou bem com o óleo. Este problema foi resolvido otimizando a síntese de ZnO. Em 1845, a LeClaire em Paris estava produzindo a tinta a óleo em grande escala e, em 1850, o branco de zinco estava sendo fabricado em toda a Europa. O sucesso da tinta branca de zinco deve-se às suas vantagens sobre o chumbo branco tradicional: o branco de zinco é essencialmente permanente à luz do sol, não é escurecido pelo ar com enxofre, é atóxico e mais econômico. Como o branco de zinco é tão "limpo", ele é valioso para fazer tintas com outras cores, mas torna um filme seco um tanto quebradiço quando não misturado com outras cores. Por exemplo, durante o final da década de 1890 e início de 1900, alguns artistas usaram o branco de zinco como base para suas pinturas a óleo. Todas essas pinturas desenvolveram rachaduras ao longo dos anos.
Recentemente, a maior parte do óxido de zinco foi usada na indústria da borracha para resistir à corrosão . Na década de 1970, a segunda maior aplicação do ZnO era a fotocópia . ZnO de alta qualidade produzido pelo "processo francês" foi adicionado ao papel de fotocópia como enchimento. Essa aplicação logo foi substituída pelo titânio .
Formulários
As aplicações do pó de óxido de zinco são numerosas, e as principais estão resumidas a seguir. A maioria das aplicações explora a reatividade do óxido como um precursor de outros compostos de zinco. Para aplicações de ciência de materiais, o óxido de zinco tem alto índice de refração , alta condutividade térmica, propriedades de ligação, antibacterianas e de proteção UV. Consequentemente, é adicionado a materiais e produtos, incluindo plásticos, cerâmicas, vidro, cimento, borracha, lubrificantes, tintas, pomadas, adesivos, selantes, fabricação de concreto , pigmentos, alimentos, baterias, ferrites, retardadores de fogo, etc.
Manufatura de borracha
Entre 50% e 60% do uso de ZnO é na indústria da borracha. O óxido de zinco junto com o ácido esteárico é usado na vulcanização da borracha. O aditivo ZnO também protege a borracha de fungos (ver aplicações médicas) e da luz ultravioleta.
Indústria cerâmica
A indústria cerâmica consome uma quantidade significativa de óxido de zinco, em particular em vidrados cerâmicos e composições de frita. A capacidade de calor relativamente alta, condutividade térmica e estabilidade de alta temperatura do ZnO, juntamente com um coeficiente de expansão comparativamente baixo, são propriedades desejáveis na produção de cerâmica. O ZnO afeta o ponto de fusão e as propriedades ópticas dos esmaltes, esmaltes e formulações cerâmicas. O óxido de zinco como um fluxo secundário de baixa expansão melhora a elasticidade dos esmaltes, reduzindo a mudança na viscosidade em função da temperatura e ajuda a prevenir fissuras e tremores. Substituindo ZnO por BaO e PbO, a capacidade de calor é diminuída e a condutividade térmica é aumentada. O zinco em pequenas quantidades melhora o desenvolvimento de superfícies brilhantes e brilhantes. No entanto, em quantidades moderadas a altas, produz superfícies opacas e cristalinas. Com relação à cor, o zinco tem uma influência complicada.
Medicina
O óxido de zinco como uma mistura com cerca de 0,5% de óxido de ferro (III) (Fe 2 O 3 ) é chamado de calamina e é usado em loções de calamina. Dois minerais, zincita e hemimorfita , foram historicamente chamados de calamina . Quando misturado ao eugenol , forma-se um ligante , o óxido de zinco eugenol , que tem aplicações como restaurador e protodôntico na odontologia .
Refletindo as propriedades básicas do ZnO, as partículas finas do óxido têm propriedades desodorizantes e antibacterianas e, por essa razão, são adicionadas a materiais como tecido de algodão, borracha, produtos para higiene bucal e embalagens de alimentos. A ação antibacteriana aprimorada de partículas finas em comparação com o material a granel não é exclusiva do ZnO e é observada para outros materiais, como a prata . Esta propriedade resulta do aumento da área de superfície das partículas finas.
O óxido de zinco é usado na lavagem da boca produtos e pastas de dentes como um agente anti-bacteriano proposto para evitar que a placa e tártaro formação, e a controlar o mau hálito , reduzindo os voláteis gases e os compostos voláteis de enxofre (VSC) na boca. Junto com óxido de zinco ou sais de zinco, esses produtos também comumente contêm outros ingredientes ativos, como cloreto de cetilpiridínio , xilitol , hinokitiol , óleos essenciais e extratos vegetais .
O óxido de zinco é amplamente utilizado para tratar uma variedade de doenças de pele, incluindo dermatite atópica , dermatite de contato , coceira devido a eczema , assaduras e acne . O óxido de zinco também é frequentemente adicionado aos filtros solares .
É usado em produtos como talco para bebês e cremes de barreira para tratar assaduras , creme de calamina , xampus anticaspa e pomadas antissépticas . É também um componente de fita adesiva (chamada "fita de óxido de zinco") usada por atletas como curativo para evitar danos aos tecidos moles durante os treinos.
O óxido de zinco pode ser usado em pomadas, cremes e loções para proteger contra queimaduras solares e outros danos à pele causados pela luz ultravioleta (veja protetor solar ). É o absorvedor de UVA e UVB de espectro mais amplo aprovado para uso como protetor solar pela Food and Drug Administration (FDA) dos Estados Unidos e é totalmente fotoestável. Quando usado como ingrediente em filtro solar , o óxido de zinco bloqueia os raios UVA (320–400 nm) e UVB (280–320 nm) da luz ultravioleta . O óxido de zinco e o outro protetor solar físico mais comum , o dióxido de titânio , são considerados não irritantes, não alérgicos e não comedogênicos . O zinco do óxido de zinco é, no entanto, ligeiramente absorvido pela pele.
Muitos filtros solares usam nanopartículas de óxido de zinco (junto com nanopartículas de dióxido de titânio) porque essas pequenas partículas não espalham a luz e, portanto, não parecem brancas. As nanopartículas não são absorvidas pela pele mais do que as partículas de óxido de zinco de tamanho normal, e só são absorvidas na camada mais externa da pele, mas não no corpo.
Nanopartículas de óxido de zinco podem aumentar a atividade antibacteriana da ciprofloxacina . Foi demonstrado que o nano ZnO com tamanho médio entre 20 nm e 45 nm pode aumentar a atividade antibacteriana da ciprofloxacina contra Staphylococcus aureus e Escherichia coli in vitro . O efeito de aumento deste nanomaterial é dependente da concentração contra todas as cepas de teste. Este efeito pode ser devido a dois motivos. Primeiro, as nanopartículas de óxido de zinco podem interferir com a proteína NorA, que é desenvolvida para conferir resistência em bactérias e tem atividade de bombeamento que medeia o efluxo de fluoroquinolonas hidrofílicas de uma célula. Em segundo lugar, as nanopartículas de óxido de zinco podem interferir com a proteína Omf, que é responsável pela penetração dos antibióticos quinolonas na célula.
Filtros de cigarro
O óxido de zinco é um componente dos filtros de cigarro . Um filtro que consiste em carvão impregnado com óxido de zinco e óxido de ferro remove quantidades significativas de cianeto de hidrogênio ( HCN ) e sulfeto de hidrogênio ( H 2 S ) da fumaça do tabaco, sem afetar seu sabor.
Aditivo alimentar
O óxido de zinco é adicionado a muitos produtos alimentícios, incluindo cereais matinais , como uma fonte de zinco, um nutriente necessário . ( O sulfato de zinco também é usado para o mesmo propósito.) Alguns alimentos pré-embalados também incluem traços de ZnO, mesmo que não seja um nutriente.
O óxido de zinco foi relacionado à contaminação por dioxina nas exportações de carne suína na crise suína chilena de 2008 . A contaminação foi encontrada devido ao óxido de zinco contaminado com dioxina usado na alimentação de suínos.
Pigmento
O branco de zinco é usado como pigmento em tintas e é mais opaco que o litopone , mas menos opaco que o dióxido de titânio . Também é usado em revestimentos para papel. O branco chinês é um grau especial de branco de zinco usado em pigmentos para artistas . O uso do branco de zinco (óxido de zinco) como pigmento na pintura a óleo teve início em meados do século XVIII. Substituiu parcialmente o venenoso chumbo branco e foi usado por pintores como Böcklin , Van Gogh , Manet , Munch e outros. É também um ingrediente principal da maquiagem mineral (CI 77947).
Absorvedor de UV
O óxido de zinco e o dióxido de titânio micronizado e em nanoescala fornecem forte proteção contra a radiação ultravioleta UVA e UVB e são usados em loções bronzeadoras e também em óculos de sol com bloqueio de UV para uso no espaço e para proteção durante a soldagem , seguindo pesquisas feitas por cientistas da Jet Laboratório de Propulsão ( JPL ).
Revestimentos
Tintas contendo pó de óxido de zinco há muito são utilizadas como revestimentos anticorrosivos para metais. Eles são especialmente eficazes para ferro galvanizado. O ferro é difícil de proteger porque sua reatividade com revestimentos orgânicos leva à fragilidade e falta de adesão. As tintas de óxido de zinco retêm sua flexibilidade e aderência em tais superfícies por muitos anos.
ZnO altamente tipo n dopado com alumínio , gálio ou índio é transparente e condutivo ( transparência ~ 90%, resistividade mais baixa ~ 10 −4 Ω · cm). ZnO: Os revestimentos de Al são usados para janelas que economizam energia ou protegem o calor. O revestimento permite a entrada da parte visível do espectro, mas reflete a radiação infravermelha (IR) de volta para a sala (economia de energia) ou não deixa a radiação IR entrar na sala (proteção contra calor), dependendo de qual lado da janela o revestimento.
Plásticos, como o naftalato de polietileno (PEN), podem ser protegidos pela aplicação de revestimento de óxido de zinco. O revestimento reduz a difusão de oxigênio com PEN. Camadas de óxido de zinco também podem ser usadas em policarbonato em aplicações externas. O revestimento protege o policarbonato da radiação solar e diminui sua taxa de oxidação e foto-amarelecimento.
Prevenção de corrosão em reatores nucleares
O óxido de zinco empobrecido em 64 Zn (o isótopo de zinco com massa atômica 64) é usado na prevenção da corrosão em reatores nucleares de água pressurizada . O esgotamento é necessário, pois o 64 Zn é transformado em 65 Zn radioativo sob a irradiação dos nêutrons do reator.
Reforma de metano
O óxido de zinco (ZnO) é usado como uma etapa de pré-tratamento para remover o sulfeto de hidrogênio (H 2 S) do gás natural após a hidrogenação de quaisquer compostos de enxofre antes de um reformador de metano , que pode envenenar o catalisador. A temperaturas entre cerca de 230-430 ° C (446-806 ° F), H 2 S é convertido em água através da reacção seguinte:
- H 2 S + ZnO → H 2 O + ZnS
O sulfeto de zinco (ZnS) é substituído por óxido de zinco fresco quando o óxido de zinco é consumido.
Aplicações potenciais
Eletrônicos
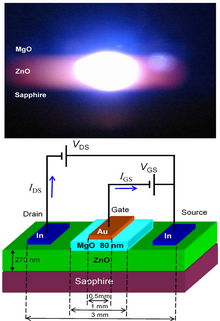

O ZnO tem um amplo gap direto de banda (3,37 eV ou 375 nm à temperatura ambiente). Portanto, suas aplicações potenciais mais comuns são em diodos laser e diodos emissores de luz (LEDs). Algumas aplicações optoeletrônicas do ZnO se sobrepõem com a do GaN , que tem um gap similar (~ 3,4 eV em temperatura ambiente). Comparado ao GaN, o ZnO tem uma energia de ligação de excitons maior (~ 60 meV, 2,4 vezes a energia térmica à temperatura ambiente), o que resulta em emissão brilhante à temperatura ambiente do ZnO. ZnO pode ser combinado com GaN para aplicações de LED. Por exemplo, como camada de óxido condutor transparente e nanoestruturas de ZnO fornecem melhor acoplamento externo de luz. Outras propriedades do ZnO favoráveis para aplicações eletrônicas incluem sua estabilidade à radiação de alta energia e sua possibilidade de ser padronizado por corrosão química úmida. A resistência à radiação torna o ZnO um candidato adequado para aplicações espaciais. O ZnO é o candidato mais promissor no campo dos lasers aleatórios para produzir uma fonte de laser UV bombeado eletronicamente.
As pontas pontiagudas dos nanobastões de ZnO resultam em um forte aumento de um campo elétrico. Portanto, eles podem ser usados como emissores de campo .
Camadas de ZnO dopadas com alumínio são usadas como eletrodos transparentes . Os componentes Zn e Al são muito mais baratos e menos tóxicos em comparação com o óxido de índio e estanho (ITO) geralmente usado . Uma aplicação que começou a estar comercialmente disponível é o uso do ZnO como contato frontal para células solares ou para telas de cristal líquido .
Transistores de filme fino transparente (TTFT) podem ser produzidos com ZnO. Como transistores de efeito de campo, eles podem até não precisar da junção ap – n, evitando assim o problema de dopagem tipo p do ZnO. Alguns dos transistores de efeito de campo até usam nanobastões de ZnO como canais condutores.
Sensor de nanobastão de óxido de zinco
Sensores de nanobastão de óxido de zinco são dispositivos que detectam mudanças na corrente elétrica que passa por nanofios de óxido de zinco devido à adsorção de moléculas de gás. A seletividade ao gás hidrogênio foi alcançada pela pulverização de aglomerados de Pd na superfície do nanorod. A adição de Pd parece ser eficaz na dissociação catalítica de moléculas de hidrogênio em hidrogênio atômico, aumentando a sensibilidade do dispositivo sensor. O sensor detecta concentrações de hidrogênio abaixo de 10 partes por milhão em temperatura ambiente, enquanto não há resposta ao oxigênio. O ZnO tem sido utilizado como camadas de imobilização em imunossensores permitindo a distribuição de anticorpos por toda a região sondada pela medição do campo elétrico aplicado aos microeletrodos.
Spintrônica
O ZnO também foi considerado para aplicações em spintrônica : se dopado com 1–10% de íons magnéticos (Mn, Fe, Co, V, etc.), o ZnO pode se tornar ferromagnético , mesmo em temperatura ambiente. Tal ferromagnetismo à temperatura ambiente em ZnO: Mn foi observado, mas não está claro ainda se ele se origina da própria matriz ou de fases de óxido secundárias.
Piezoeletricidade
A piezoeletricidade em fibras têxteis revestidas em ZnO tem se mostrado capaz de fabricar "nanossistemas autoalimentados" com o estresse mecânico diário do vento ou dos movimentos do corpo.
Em 2008, o Center for Nanostructure Characterization do Georgia Institute of Technology relatou a produção de um dispositivo de geração de eletricidade (chamado gerador de bomba de carga flexível) fornecendo corrente alternada alongando e liberando nanofios de óxido de zinco. Este minigerador cria uma tensão oscilante de até 45 milivolts, convertendo cerca de sete por cento da energia mecânica aplicada em eletricidade. Os pesquisadores usaram fios com comprimentos de 0,2–0,3 mm e diâmetros de três a cinco micrômetros, mas o dispositivo pode ser reduzido para um tamanho menor.
Na forma de um filme fino, o ZnO foi demonstrado em ressoadores, sensores e filtros de filme fino miniaturizados de alta frequência.
Bateria de íon-lítio
ZnO é um material de ânodo promissor para bateria de íon de lítio porque é barato, biocompatível e ecologicamente correto. ZnO tem uma capacidade teórica mais alta (978 mAh g -1 ) do que muitos outros óxidos de metal de transição, como CoO (715 mAh g -1 ), NiO (718 mAh g -1 ) e CuO (674 mAh g -1 ).
Segurança
Como aditivo alimentar , o óxido de zinco está na lista do FDA dos EUA de substâncias geralmente reconhecidas como seguras , ou GRAS.
O óxido de zinco em si não é tóxico; é perigoso, entretanto, inalar vapores de óxido de zinco, como os gerados quando o zinco ou ligas de zinco são derretidos e oxidados em alta temperatura. Esse problema ocorre durante a fusão de ligas contendo latão porque o ponto de fusão do latão está próximo ao ponto de ebulição do zinco. A exposição a óxido de zinco no ar, que também ocorre durante a soldagem galvanizado (zincado) de aço , pode resultar numa doença chamada febre do vapor de metal . Por este motivo, normalmente o aço galvanizado não é soldado ou o zinco é removido primeiro.
Veja também
Referências
Fontes citadas
- Haynes WM, ed. (2011). CRC Handbook of Chemistry and Physics (92ª ed.). CRC Press . ISBN 978-1439855119.
Avaliações
- Özgür Ü, Alivov YI, Liu C, Teke A, Reshchikov M, Doğan S, et al. (2005). "Uma análise abrangente dos materiais e dispositivos ZnO" . Journal of Applied Physics . 98 (4): 041301–041301–103. Bibcode : 2005JAP .... 98d1301O . doi : 10.1063 / 1.1992666 .
- Bakin A, Waag A (29 de março de 2011). "ZnO Epitaxial Growth". Em Bhattacharya P, Fornari R, Kamimura H (eds.). Comprehensive Semiconductor Science and Technology 6 Volume Encyclopaedia . Elsevier. ISBN 978-0-444-53143-8.
- Baruah S, Dutta J (fevereiro de 2009). Crescimento hidrotérmico de nanoestruturas de ZnO " . Ciência e Tecnologia de Materiais Avançados . 10 (1): 013001. bibcode : 2009STAdM..10a3001B . doi : 10.1088 / 1468-6996 / 10/1/013001 . PMC 5109597 . PMID 27877250 .
- Janisch R (2005). "TiO 2 dopado com metal de transição e ZnO - estado atual do campo". Journal of Physics: Condensed Matter . 17 (27): R657 – R689. Bibcode : 2005JPCM ... 17R.657J . doi : 10.1088 / 0953-8984 / 17/27 / R01 .
- Heo YW (2004). "Crescimento de nanofios ZnO e dispositivos". Ciência e Engenharia de Materiais: R: Relatórios . 47 (1–2): 1–47. doi : 10.1016 / j.mser.2004.09.001 .
- Klingshirn C (2007). "ZnO: do básico aos aplicativos". Physica Estado Solidi B . 244 (9): 3027–3073. Bibcode : 2007PSSBR.244.3027K . doi : 10.1002 / pssb.200743072 .
- Klingshirn C (abril de 2007). “ZnO: material, física e aplicações” . ChemPhysChem . 8 (6): 782–803. doi : 10.1002 / cphc.200700002 . PMID 17429819 .
- Lu JG, Chang P, Fan Z (2006). "Materiais de óxido de metal quase unidimensional - Síntese, propriedades e aplicações". Ciência e Engenharia de Materiais: R: Relatórios . 52 (1–3): 49–91. CiteSeerX 10.1.1.125.7559 . doi : 10.1016 / j.mser.2006.04.002 .
- Xu S, Wang ZL (2011). "Nanoestruturas unidimensionais de ZnO: crescimento da solução e propriedades funcionais". Nano Research . 4 (11): 1013–1098. CiteSeerX 10.1.1.654.3359 . doi : 10.1007 / s12274-011-0160-7 . S2CID 137014543 .
- Xu S, Wang ZL (2011). "Matrizes de nanofios de óxido para diodos emissores de luz e coletores de energia piezoelétricos". Química pura e aplicada . 83 (12): 2171–2198. doi : 10.1351 / PAC-CON-11-08-17 . S2CID 18770461 .
links externos
- Propriedades de zincita
- Cartão Internacional de Segurança Química 0208 .
- Guia de bolso do NIOSH para perigos químicos .
- Óxido de zinco na base de dados de propriedades de pesticidas (PPDB)
- Pigmento branco de zinco em ColourLex






