Aldeído ferredoxina oxidoredutase - Aldehyde ferredoxin oxidoreductase
| Aldeído ferredoxina oxidoredutase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| EC nº | 1.2.7.5 | ||||||||
| CAS no. | 138066-90-7 | ||||||||
| Bancos de dados | |||||||||
| IntEnz | Vista IntEnz | ||||||||
| BRENDA | Entrada BRENDA | ||||||||
| ExPASy | NiceZyme view | ||||||||
| KEGG | Entrada KEGG | ||||||||
| MetaCyc | via metabólica | ||||||||
| PRIAM | perfil | ||||||||
| Estruturas PDB | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
| AFOR_N | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 estrutura de uma enzima tungstopterina hipertermofílica, aldeído ferredoxina oxidoredutase
| |||||||||
| Identificadores | |||||||||
| Símbolo | AFOR_N | ||||||||
| Pfam | PF02730 | ||||||||
| InterPro | IPR013983 | ||||||||
| SCOP2 | 1aor / SCOPe / SUPFAM | ||||||||
| |||||||||
| AFOR_C | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| Símbolo | AFOR_C | ||||||||
| Pfam | PF01314 | ||||||||
| InterPro | IPR001203 | ||||||||
| SCOP2 | 1aor / SCOPe / SUPFAM | ||||||||
| |||||||||
Em enzimologia , uma aldeído ferredoxina oxidorredutase ( EC 1.2.7.5 ) é uma enzima que catalisa a reação química
- um aldeído + H 2 O + 2 ferredoxina oxidada ⇌ um ácido + 2 H + + 2 ferredoxina reduzida
Esta enzima pertence à família das oxidorredutases , especificamente aquelas que atuam no grupo aldeído ou oxo do doador com uma proteína ferro-enxofre como aceptora. O nome sistemático desta classe de enzimas é aldeído: ferredoxina oxidoredutase . Esta enzima também é chamada de AOR . É um exemplo relativamente raro de proteína contendo tungstênio.
Ocorrência
O sítio ativo da família AOR apresenta um centro de oxo-tungstênio ligado a um par de cofatores de molibdopterina (que não contém molibdênio) e um cluster 4Fe-4S . Esta família inclui AOR, formaldeído ferredoxina oxidorredutase (DE), gliceraldeído-3-fosfato ferredoxina oxidorredutase (GAPOR), todas isoladas a partir de hiperterm�ila Archea ; redutase de ácido carboxílico encontrada em clostrídios; e hidroxicarboxilato viologen oxidoredutase de Proteus vulgaris , o único membro da família AOR contendo molibdênio. GAPOR pode estar envolvido na glicólise , mas as funções das outras proteínas ainda não estão claras. A AOR foi proposta como a principal enzima responsável pela oxidação dos aldeídos que são produzidos pelas oxidorredutases de 2-cetoácidos .
AOR é encontrada em archaea hipertermofílica , Pyrococcus furiosus . A cepa de archaeons Pyrococcus ES-4 e a cepa Thermococcus ES-1 diferem por sua especificidade de substrato: AFOs mostram uma faixa de tamanho mais ampla de seus substratos de aldeído . Seu papel principal é oxidar aldeído oriundo do metabolismo de aminoácidos e glicoses. Aldeído Ferredoxina Oxidoredutase é um membro de uma família AOR, que inclui gliceraldeído-3-fosfato ferredoxina oxidoredutase (GAPOR) e Formaldeído Ferredoxina Oxidoredutase.
Função
AOR funciona em condições de alta temperatura (~ 80 graus Celsius) em um pH ideal de 8-9. É sensível ao oxigênio, pois perde a maior parte de sua atividade com a exposição ao oxigênio e atua no citoplasma, onde é um ambiente redutor. Assim, a exposição ao oxigênio ou a redução da temperatura causa uma perda irreversível de suas propriedades catalíticas. Além disso, como resultado da sensibilidade do AOR ao oxigênio, a purificação da enzima é feita em ambientes anóxicos .
É proposto que AOR tem um papel na via de Entner-Doudoroff (degradação da glicose) devido ao seu aumento de atividade com a incorporação de maltose . No entanto, outras propostas incluem seu papel na oxidação de produtos colaterais de aldeído do metabolismo de aminoácidos provenientes de 2-cetoácidos desaminados. Os principais substratos da aldeído ferredoxina oxidoredutase são acetaldeído , fenilacetaldeído e isovalerdeído, que é um produto metabólico de aminoácidos comuns e glicose. Por exemplo, o acetaldeído atinge seu valor kcat / KM até 22,0 μM-1s-1. Na verdade, alguns microrganismos só fazem uso de aminoácidos como fonte de carbono, como o Thermococcus cepa ES1; assim, eles utilizam aldeído ferredoxina oxidoredutase para metabolizar a fonte de carbono do aminoácido.
Estrutura
AOR é homodimérico. Cada subunidade de 67kDa contém 1 átomo de tungstênio e 4-5 átomos de ferro . As duas subunidades são interligadas por um centro de ferro de baixa rotação. Acredita-se que as duas subunidades funcionem independentemente.
- Tungstênio-pterina
O tungstênio no sítio ativo de AOR adota uma geometria piramidal quadrada distorcida ligada a um ligante oxo / hidroxo e os substituintes ditioleno de dois cofatores de molibdopterina .
Dois cofatores de molibdopterina ligam-se ao tungstênio, como observado em muitas enzimas relacionadas. O tungstênio não está ligado diretamente à proteína. Os centros de fosfato pendentes no cofator estão ligados a um Mg 2+ , que também é ligado por Asn93 e Ala183 para completar sua esfera de coordenação octaédrica. Assim, os átomos de pterina e tungstênio são conectados à enzima AOR principalmente por meio das redes de ligações de hidrogênio da pterina com os resíduos de aminoácidos. Além disso, dois ligantes de água que ocupam a geometria octaédrica participam de redes de ligações de hidrogênio com pterina, fosfato e Mg 2+ . Enquanto o cluster [Fe4S4] é ligado por quatro ligantes Cys, a Pterina - rica em ligações amino e éter - interage com as sequências Asp-XX-Gly-Leu- (Cys / Asp) na enzima AOR. Em tal sequência, o resíduo Cys494 também é ligado por hidrogênio ao agrupamento [Fe4S4]. Isso indica que o resíduo Cys494 conecta o local do tungstênio e o local do cluster [Fe4S4] na enzima. O átomo de ferro no cluster é adicionalmente ligado por três outros ligantes de cisteína:. Além disso, outro resíduo de aminoácido ligante entre o agrupamento da ferredoxina e a pterina é o Arg76, que se liga ao hidrogênio tanto à pterina quanto à ferredoxina. É proposto que tais interações por ligações de hidrogênio implicam no sistema de anéis cíclicos de pterina como um transportador de elétrons. Além disso, o centro C = O da pterina se liga ao Na + . O centro W = O é proposto, não verificado cristalograficamente.
AOR consiste em três domínios, domínio 1, 2 e 3. Enquanto o domínio 1 contém pterina ligada ao tungstênio, os outros dois domínios fornecem um canal do tungstênio para a superfície da proteína (15 Angstroms de comprimento), a fim de permitir que substratos específicos entrem no enzima através de seu canal. No sítio ativo, esta molécula de pterina está em uma conformação semelhante a uma sela (500 ao plano normal) para "sentar-se" no domínio 1, que também assume uma forma com folhas beta para acomodar o sítio Tungstênio-Pterina.
- Ferro
O centro de ferro entre as duas subunidades desempenha um papel estrutural na AOR. Os átomos do metal de ferro assumem uma conformação tetraédrica, enquanto a coordenação do ligante vem de duas histidinas e ácidos glutâmicos. Este não é conhecido por ter qualquer papel funcional na atividade redox da proteína.
- Centro Fe4S4
O cluster [Fe4S4] em AOR é diferente em alguns aspectos de outras moléculas de ferredoxina. As medições EPR confirmam que ele funciona como um lançador de um elétron.
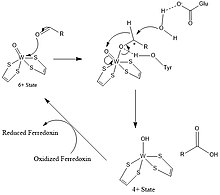
Mecanismo de aldeído ferredoxina oxidoredutase
No ciclo catalítico, W (VI) (tungstênio "seis") se converte em W (IV) concomitante com a oxidação do aldeído em um ácido carboxílico (equivalentemente, um carboxilato). O intermediário AW (V) pode ser detectado por espectroscopia EPR .
Mecanismo de reação geral de AOR:
- RCHO + H2O → RCO 2 H + 2H + + 2 e -
Os equivalentes redox são fornecidos pelo cluster 4Fe-4S.
Um resíduo de tirosina é proposto para ativar o centro eletrofílico de aldeídos por ligação H ao átomo de oxigênio da carbonila, coordenado ao centro W. Um resíduo de ácido glutâmico próximo ao sítio ativo ativa uma molécula de água para um ataque nucleofílico ao centro de carbonil aldeído. Após o ataque nucleofílico pela água, o hidreto é transferido para o estado de oxo-tungstênio, portanto,. Posteriormente, W (VI) é regenerado por transferência de elétrons para o centro 4Fe-4S. Com formaldeído ferredoxina oxidoredutase, Glu308 e Tyr 416 estariam envolvidos, enquanto Glu313 e His448 estão presentes no sítio ativo de AOR.
Referências
Leitura adicional
- Mukund S, Adams MW (1991). "A nova proteína de tungstênio-ferro-enxofre da arqueobactéria hipertermofílica, Pyrococcus furiosus, é uma aldeído ferredoxina oxidorredutase. Evidência de sua participação em uma via glicolítica única" . J. Biol. Chem . 266 (22): 14208–16. doi : 10.1016 / S0021-9258 (18) 98669-2 . PMID 1907273 .
- Johnson JL, Rajagopalan KV, Mukund S, Adams MW (1993). "Identificação de molibdopterina como o componente orgânico do cofator de tungstênio em quatro enzimas de arquéias hipertermofílicas" . J. Biol. Chem . 268 (7): 4848–52. doi : 10.1016 / S0021-9258 (18) 53474-8 . PMID 8444863 .
- Roy R, Menon AL, Adams MW (2001). "Aldeído oxidoredutases de Pyrococcus furiosus". Methods Enzymol . 331 : 132–44. doi : 10.1016 / S0076-6879 (01) 31052-2 . PMID 11265456 .