Orbital molecular de ligação - Bonding molecular orbital
O orbital de ligação é usado na teoria dos orbitais moleculares (MO) para descrever as interações atrativas entre os orbitais atômicos de dois ou mais átomos em uma molécula. Na teoria MO, os elétrons são retratados como se movendo em ondas. Quando mais de uma dessas ondas se aproximam, a combinação em fase dessas ondas produz uma interação que leva a uma espécie que é bastante estabilizada. O resultado da interferência construtiva das ondas faz com que a densidade dos elétrons seja encontrada dentro da região de ligação, criando uma ligação estável entre as duas espécies.
Moléculas diatômicas
No exemplo clássico do H 2 MO, os dois átomos de H separados têm orbitais atômicos idênticos. Ao criar a molécula dihidrogênio, os orbitais de valência individuais, 1 s , ou: fundem-se em fase para obter orbitais de ligação, onde a densidade de elétrons está entre os núcleos dos átomos; ou, fundir fora de fase para obter orbitais anti-ligação, onde a densidade do elétron está em toda parte ao redor do átomo, exceto no espaço entre os núcleos dos dois átomos. Orbitais de ligação levam a uma espécie mais estável do que quando os dois hidrogênios são monoatômicos. Orbitais anti-ligação são menos estáveis porque, com muito pouca ou nenhuma densidade de elétrons no meio, os dois núcleos (mantendo a mesma carga) se repelem. Portanto, seria necessário mais energia para manter os dois átomos juntos por meio do orbital anti-ligação. Cada electrões na valência 1 s casca de hidrogénio juntam-se para preencher a ligação estabilização orbital. Portanto, o hidrogênio prefere existir como uma molécula diatômica, e não monoatômica.
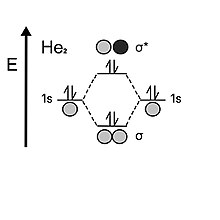
Ao olhar para o hélio, o átomo contém dois elétrons em cada camada de valência de 1 s . Quando os dois orbitais atômicos se juntam, eles primeiro preenchem o orbital de ligação com dois elétrons, mas, ao contrário do hidrogênio, ele tem dois elétrons restantes, que devem então ir para o orbital anti-ligação. A instabilidade do orbital anti-aderente cancela o efeito estabilizador fornecido pelo orbital aderente; portanto, a ordem de ligação do diélio é 0. É por isso que o hélio prefere ser monoatômico a diatômico.
Moléculas poliatômicas
Ligando MOs de ligações pi
As ligações Pi são criadas pelas interações “laterais” dos orbitais. Mais uma vez, nos orbitais moleculares, os elétrons pi (π) de ligação ocorrem quando a interação dos dois orbitais atômicos π está em fase. Nesse caso, a densidade de elétrons dos orbitais π precisa ser simétrica ao longo do plano do espelho para criar a interação de ligação. A assimetria ao longo do plano do espelho levará a um nó naquele plano e é descrita no orbital anti-aderente, π *.
Um exemplo de MO de um sistema π conjugado simples é o butadieno. Para criar o MO para o butadieno , os orbitais π e π * resultantes do sistema descrito anteriormente irão interagir uns com os outros. Esta mistura resultará na criação de 4 orbitais de grupo (que também podem ser usados para descrever o π MO de qualquer dieno): π 1 não contém nós verticais , π 2 contém um e ambos são considerados orbitais de ligação; π 3 contém 2 nós verticais, π 4 contém 3 e são ambos considerados orbitais anti-aderentes.
Orbitais moleculares localizados
A forma 3D esférica dos orbitais s não tem direcionalidade no espaço e os orbitais p x , p y e p z estão todos a 90 o um em relação ao outro. Portanto, a fim de obter orbitais correspondentes a ligações químicas para descrever reações químicas, Edmiston e Ruedenberg foram os pioneiros no desenvolvimento de procedimentos de localização. Por exemplo, em CH 4 , os quatro elétrons dos orbitais 1 s dos átomos de hidrogênio e os elétrons de valência do átomo de carbono (2 em s e 2 em p ) ocupam os orbitais moleculares de ligação, σ e π. Os MOs deslocalizados do átomo de carbono na molécula de metano podem então ser localizados para dar quatro orbitais híbridos sp 3 .
Formulários
Orbitais moleculares e, mais especificamente, o orbital de ligação é uma teoria que é ensinada em todas as áreas da química, da orgânica à física e até analítica, porque é amplamente aplicável. Os químicos orgânicos usam a teoria orbital molecular em seu raciocínio lógico para as reações; os químicos analíticos usam-no em diferentes métodos de espectroscopia; os físicos químicos o usam em cálculos; ele é visto até mesmo na química de materiais por meio da teoria das bandas - uma extensão da teoria orbital molecular.
Referências
- ^ Mulliken, Robert S. (1932). "Estruturas eletrônicas de moléculas poliatômicas e valência. II. Considerações gerais". Revisão física . 41 (1): 49–71. Bibcode : 1932PhRv ... 41 ... 49M . doi : 10.1103 / physrev.41.49 .
- ^ Sannigrahi, AB; Kar, Tapas (01/08/1988). "Teoria orbital molecular da ordem e valência das ligações". Journal of Chemical Education . 65 (8): 674. Bibcode : 1988JChEd..65..674S . doi : 10.1021 / ed065p674 . ISSN 0021-9584 .
- ^ a b c d e 1960, Anslyn, Eric V. (2006). Química física orgânica moderna . Dougherty, Dennis A., 1952-. Sausalito, CA: University Science. ISBN 978-1891389313. OCLC 55600610 .CS1 maint: nomes numéricos: lista de autores ( link )
- ^ Lennard-Jones, JE (1929-01-01). "A estrutura eletrônica de algumas moléculas diatômicas". Transações da Sociedade Faraday . 25 : 668. bibcode : 1929FaTr ... 25..668L . doi : 10.1039 / tf9292500668 . ISSN 0014-7672 .
- ^ Housecroft, Catherine E. (2012). Química inorgânica . Sharpe, AG (4ª ed.). Harlow, Inglaterra: Pearson. ISBN 9780273742753. OCLC 775664094 .
- ^ a b Cohen, Irwin; Del Bene, Janet (01/08/1969). "Orbitais híbridos na teoria orbital molecular". Journal of Chemical Education . 46 (8): 487. bibcode : 1969JChEd..46..487C . doi : 10.1021 / ed046p487 . ISSN 0021-9584 .
- ^ Edmiston, Clyde (1963). "Localized Atomic and Molecular Orbitals". Avaliações da Física Moderna . 35 (3): 457–464. Bibcode : 1963RvMP ... 35..457E . doi : 10.1103 / revmodphys.35.457 .
- ^ a b Dannenberg, JJ (1999-05-12). "Usando a Teoria Orbital Molecular de Perturbação e Fronteira para Predizer a Seletividade Diastereofacial". Revisões químicas . 99 (5): 1225–1242. doi : 10.1021 / cr980382f . ISSN 0009-2665 . PMID 11749445 .
- ^ Li, Yongjun; Jia, Zhiyu; Xiao, Shengqiang; Liu, Huibiao; Li, Yuliang (16/05/2016). "Um método para controlar a síntese de moléculas conjugadas bidimensionais torcidas estáveis" . Nature Communications . 7 : 11637. bibcode : 2016NatCo ... 711637L . doi : 10.1038 / ncomms11637 . PMC 4873669 . PMID 27181692 .
- ^ Smith, Wendell F. (1963). "Aplicação da teoria orbital molecular aos espectros de absorção eletrônica de bases de Schiff". Tetraedro . 19 (3): 445–454. doi : 10.1016 / s0040-4020 (01) 99192-6 .
- ^ Mulliken, Robert S. (07/07/1967). "Spectroscopy, Molecular Orbitals, and Chemical Bonding". Ciência . 157 (3784): 13–24. Bibcode : 1967Sci ... 157 ... 13M . doi : 10.1126 / science.157.3784.13 . ISSN 0036-8075 . PMID 5338306 .
- ^ Gimarc, Benjamin M. (1974). "Aplicações da teoria orbital molecular qualitativa". Contas de pesquisa química . 7 (11): 384–392. doi : 10.1021 / ar50083a004 .
- ^ Brédas, JL; Calbert, JP; da Silva Filho, DA; Cornil, J. (30/04/2002). "Semicondutores orgânicos: Uma caracterização teórica dos parâmetros básicos que regem o transporte de carga" . Proceedings of the National Academy of Sciences . 99 (9): 5804–5809. Bibcode : 2002PNAS ... 99.5804B . doi : 10.1073 / pnas.092143399 . PMC 122857 . PMID 11972059 .