Contraíon - Counterion

Um contra-íon (pronunciado como duas palavras, ou seja, "contra" "íon", e às vezes escrito como duas palavras) é o íon que acompanha uma espécie iônica para manter a neutralidade elétrica. No sal de cozinha (NaCl, também conhecido como cloreto de sódio), o íon sódio (carregado positivamente) é o contra-íon do íon cloreto (carregado negativamente) e vice-versa.
Um contra-íon será mais comumente referido como um ânion ou um cátion , dependendo se ele tem carga negativa ou positiva. Assim, o contra-íon para um ânion será um cátion e vice-versa.
Química interfacial
Os contra-íons são os íons móveis em polímeros de troca iônica e coloides . As resinas de troca iônica são polímeros com uma carga líquida negativa ou positiva. As resinas de troca catiônica consistem em um polímero aniônico com contra-cátions, tipicamente Na + (sódio). A resina tem maior afinidade para contra-cátions altamente carregados, por exemplo, por Ca 2+ (cálcio) no caso de amaciamento de água . Correspondentemente, as resinas de permuta aniónica são tipicamente fornecida sob a forma de cloreto de Cl - , que é um couteranion altamente móvel.
Os contra-íons são usados na catálise de transferência de fase . Em uma aplicação típica, o contra-cátion lipofílico, como o benzalcônio, solubiliza reagentes em solventes orgânicos.
Química da Solução
A solubilidade de sais em solventes orgânicos é uma função tanto do cátion quanto do ânion. A solubilidade de cátions em solventes orgânicos pode ser aumentada quando o ânion é lipofílico. Da mesma forma, a solubilidade de ânions em solventes orgânicos é aumentada com cátions lipofílicos. Os cátions lipofílicos mais comuns são cátions de amônio quaternário , chamados de "sais quat".
- Contra-ânions lipofílicos
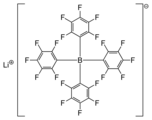
O tetraquis (pentafluorofenil) borato de lítio é o sal de lítio de um ânion tetraarilborato altamente lipofílico, freqüentemente referido como ânion de coordenação fraca .
O tetrafenilborato é menos lipofílico do que o derivado perfluorado, mas amplamente utilizado como agente precipitante.
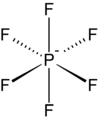
O hexafluorofosfato é um ânion comum de coordenação fraca .
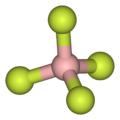
Conforme ilustrado pelo pequeno contra- ânion tetrafluoroborato ( BF -
4 ), os cátions lipofílicos tendem a ser simétricos e com carga simples.
- Contra-cátions lipofílicos
Cloreto de bis (trifenilfosfina) imínio é o sal cloreto de um cátion fosfônio lipofílico volumoso [Ph 3 PNPPh 3 ] + .
Cloreto de tetrafenilfosfônio (C 6 H 5 ) 4 PCl, abreviado Ph 4 PCl ou PPh 4 Cl é o cloreto de um cátion fosfônio simétrico que é freqüentemente usado em química organometálica . O sal de incêndio também é bem conhecido.
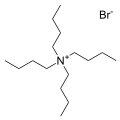
O sal brometo de tetrabutilamônio , um dos contra-cátions mais comuns. Muitos "sais quat" análogos são conhecidos.
Os cátions de metal alcalino ligados por éteres coroa são contra- cátions lipofílicos comuns, conforme ilustrado por [Li (12-coroa-4) 2 ] + .
Muitos complexos organometálicos catiônicos são isolados com contra-íons inertes e não coordenadores. O tetrafluoroborato de ferrocênio é um exemplo.
Eletroquímica
Para atingir alta condutividade iônica, as medições eletroquímicas são conduzidas na presença de excesso de eletrólito. Na água, o eletrólito é geralmente um sal simples, como o cloreto de potássio . Para medições em soluções não aquosas, sais compostos de cátions e ânions lipofílicos são empregados, por exemplo, hexafluorofosfato de tetrabutilamônio . Mesmo nesses casos, os potenciais são influenciados pelo emparelhamento iônico , um efeito que é acentuado em solventes de baixa constante dielétrica .
Estabilidade do contraíon
Para muitas aplicações, o contra-íon simplesmente fornece carga e lipofilicidade que permite a manipulação de seu íon parceiro. Espera-se que o contra-íon seja quimicamente inerte. Para contra-ânions, a inércia é expressa em termos de baixa basicidade de Lewis . Os contra-íons são idealmente robustos e não reativos. Para os contra-cátions quaternários de amônio e fosfônio, a inércia está relacionada à sua resistência à degradação por bases fortes e nucleófilos fortes.