ESCRT - ESCRT
O endossomal triagem complexos necessários para o transporte ( ESCRT ) máquinas é feita de citosólicas complexos de proteínas, conhecidos como ESCRT-0, ESCRT-I, ESCRT-II, e ESCRT-III. Junto com uma série de proteínas acessórias, esses complexos ESCRT permitem um modo único de remodelação da membrana que resulta na curvatura / brotamento das membranas do citoplasma . Esses componentes ESCRT foram isolados e estudados em vários organismos, incluindo leveduras e humanos. Uma proteína de assinatura eucariótica , a maquinaria é encontrada em todos os eucariotos e em algumas arquéias .
A maquinaria ESCRT desempenha um papel vital em vários processos celulares, incluindo biogênese do corpo multivesicular (MVB), abscisão celular e brotamento viral . A biogênese do corpo multivesicular (MVB) é um processo no qual proteínas marcadas com ubiquitina entram em organelas chamadas endossomos por meio da formação de vesículas . Esse processo é essencial para que as células destruam proteínas mal dobradas e danificadas. Sem a maquinaria ESCRT, essas proteínas podem se acumular e levar a doenças neurodegenerativas . Por exemplo, anormalidades nos componentes ESCRT-III podem levar a distúrbios neurológicos, como paraplegia espástica hereditária (HSP). A abscisão celular, o processo pelo qual a membrana que conecta duas células filhas é clivada, também é mediada por máquinas ESCRT. Sem os complexos ESCRT, as células-filhas não poderiam se separar e seriam geradas células anormais contendo o dobro da quantidade de DNA . Essas células seriam inevitavelmente destruídas por um processo conhecido como apoptose . Por último, o brotamento viral, ou o processo pelo qual tipos específicos de vírus saem das células, pode não ocorrer na ausência de maquinaria ESCRT. Isso inevitavelmente evitaria que os vírus se propagassem de uma célula para outra.
Complexos ESCRT e proteínas acessórias
Cada um dos complexos ESCRT e proteínas acessórias têm estruturas únicas que permitem funções bioquímicas distintas. Existem vários sinônimos para cada componente de proteína da máquina ESCRT, tanto para levedura quanto para metazoários . Uma tabela de resumo de todas essas proteínas é fornecida abaixo.
Na levedura, os seguintes complexos / proteínas acessórias existem como segue:
ESCRT-0
O complexo ESCRT-0 desempenha um papel vital na geração de corpos multivesiculares ao se ligar e agrupar proteínas e / ou receptores ubiquitinados na superfície de uma célula. O complexo é então responsável pela ligação a um lipídio na membrana endossômica, que recruta essas proteínas marcadas para o endossomo. Uma vez devidamente localizadas , essas proteínas são levadas para o endossomo por meio de vesículas, formando corpos multivesiculares, e são eventualmente entregues ao lisossoma, onde são degradadas. Esse processo é essencial, pois é a principal via de degradação das proteínas danificadas que passaram pelo Golgi . Os componentes do complexo ESCRT-0 existem da seguinte forma:
O complexo é um heterodímero 1: 1 de Vps27 ( proteína vacuolar de classificação 27) e Hse1 . Vps27 e Hse1 dimerizam através de domínios antiparalelos coiled-coil GAT (assim chamados após as proteínas GGA e Tom1). Ambos Vps27 e Hse1 contêm um domínio VHS amino-terminal (assim denominado porque está contido nas proteínas V ps27, H RS e S TAM). Esses domínios VHS ligam a ubiquitina às proteínas que a célula pretende degradar. A ubiquitina também pode se associar a motivos que interagem com a ubiquitina, como o de Hse1 ou o domínio de dupla face encontrado em Vps27. Um domínio FYVE (nomeado após as quatro proteínas nas quais foi inicialmente identificado: Fab1p, YOTB, Vac1 e EEA1) é encontrado imprensado entre o VHS e os domínios do motivo que interagem com a ubiquitina de Vps27. O fosfatidilinositol 3-fosfato , um lípido endossomal comum, liga-se a este domínio FYVE resultando no recrutamento de ESCRT-0 para o endossoma.
ESCRT-I
O papel do complexo ESCRT-I é auxiliar na geração de corpos multivesiculares agrupando proteínas ubiquitinadas e agindo como uma ponte entre os complexos ESCRT-0 e ESCRT-II. Ele também desempenha um papel no reconhecimento e na remodelação da membrana durante a abscisão da membrana, formando anéis em cada lado do corpo médio das células em divisão. A ESCRT-I também é responsável pelo recrutamento da ESCRT-III, que forma a zona de constrição pouco antes da separação das células. Além disso, ESCRT-I desempenha um papel no surgimento viral, interagindo com proteínas virais específicas, levando ao recrutamento de máquinas ESCRT adicionais para o local potencial de liberação viral. Os detalhes do maquinário ESCRT-I são descritos abaixo.
O complexo ESCRT-I é um heterotetrâmero (1: 1: 1: 1) de Vps23, Vps28 , Vps37 e Mvb12. O heterotetrâmero montado aparece como uma haste em forma de haste composta por Vps23, Vps37 e Mvb12 com uma tampa em leque composta por hélices simples de Vps23, Vps28 e Vps37. Vps23 contém um domínio de ubiquitina variante de E2, que é responsável pela ligação da ubiquitina, o ESCRT-0 complexo, e ao PTAP ( p Roline , t hreonine , um lanine , p Roline) motivo do virais proteínas Gag . Logo após este domínio variante da ubiquitina E2, um motivo rico em prolina (GPPX 3 Y) está presente que direciona ESCRT-I para o corpo médio durante a abscisão da membrana. O Mvb12 também pode se ligar à ubiquitina por meio de seu terminal carboxi . Vps28 é responsável pela interação de ESCRT-I e ESCRT-II por associação com o domínio GLUE ( ligação de biquitina G RAM- L ike U em E AP45) de Vps36 por meio de seu domínio de pacote de quatro hélices do terminal carboxi .
ESCRT-II
O complexo ESCRT-II funciona principalmente durante a biogênese de corpos multivesiculares e entrega de proteínas marcadas com ubiquitina ao endossomo. Proteínas marcadas com Ubiquitina são passadas de ESCRT-0 para ESCRT-I e então para ESCRT-II. ESCRT-II associa-se com ESCRT-III, que aperta a carga contendo a vesícula fechada. Os aspectos específicos do ESCRT-II são os seguintes:
ESCRT-II é um heterotetrero (2: 1: 1) composto por duas Vps25 subunidades, um Vps22, e um Vps36 subunidade. As moléculas Vps25 contêm motivos PPXY, que se ligam aos motivos de hélice alada (WH) de Vps22 e Vps36, criando um complexo em forma de Y com Vps22 e Vps36 como base e as moléculas Vps25 como braços. As moléculas Vps25 também contêm motivos WH que são responsáveis pela interação de ESCRT-II com ESCRT-III. Vps36 contém um domínio GLUE que se liga a fosfatidilinositol 3-fosfato e Vps28 de ESCRT-I. Dois domínios de dedo de zinco são inseridos no domínio GLUE da levedura Vps36. Um desses domínios de dedo de zinco se liga ao domínio carboxi-terminal de Vps28 e o outro se associa à ubiquitina.
ESCRT-III
O complexo ESCRT-III é provavelmente o mais importante de todas as máquinas ESCRT porque desempenha um papel em todos os processos mediados por ESCRT. Durante a abscisão da membrana e brotamento viral, ESCRT-III forma filamentos longos que se enrolam em torno do local de constrição da membrana imediatamente antes da clivagem da membrana. Essa mediação de abscisão ocorre por meio de interações com o complexo do eixo - eixo central . Essas estruturas filamentosas também estão presentes durante a formação do corpo multivesicular e funcionam como uma cerca em forma de anel que conecta a vesícula em formação para evitar que proteínas de carga escapem para o citosol da célula. ESCRT-III existe e funciona da seguinte forma:
O complexo ESCRT-III difere de todas as outras máquinas ESCRT porque existe apenas temporariamente e contém componentes essenciais e não essenciais. As subunidades essenciais devem ser montadas na ordem adequada (Vps20, Snf7, Vps24 e , em seguida, Vps2) para que o maquinário funcione. As subunidades não essenciais incluem Vps60, Did2 e Ist1. O Vps20 inicia a montagem do ESCRT-III agindo como um nucleador da montagem do polímero Snf7. Vps24 então se associa com Snf7 para cobrir o complexo e recrutar Vps2. O Vps2 então traz o Vps4 para o complexo. Todas as formas citosólicas “livres” de cada subunidade são consideradas fechadas. Ou seja, a porção carboxi-terminal de cada subunidade dobra-se sobre si mesma de uma maneira autoinibitória, estabilizando as subunidades monoméricas . O carboxi-terminal da maior parte das ESCRT-III subunidades, ambos essenciais e não essenciais, conter MIMs ( M TI ( microtúbulos interagir e domínio dos transportes) i nteracting m OTIF) motivos. Estes motivos são responsáveis por Vps4 e a ligação AAA-ATPase Spastin .
Vps4-Vta1
As proteínas Vps4-Vta1 são necessárias para a remoção de outros componentes ESCRT (geralmente ESCRT-III) das membranas, uma vez que um processo específico tenha sido concluído. Há algum debate se o Vps4 cliva o complexo ESCRT-III ou remodela o complexo de forma que um componente seja eliminado em um determinado momento. Acredita-se que Vta1 atue como um ativador de Vps4, auxiliando em sua montagem e aumentando sua atividade AAA-ATPase. A maneira pela qual essas proteínas funcionam é a seguinte:
As subunidades Vps4 têm dois domínios funcionais, um domínio MIT amino-terminal e um domínio AAA-ATPase central. O domínio MIT é responsável pela interação de Vps4 com o domínio MIM de Vps2. O domínio AAA-ATPase hidrolisa ATP para poder desmontar o complexo ESCRT-III. Esta “remoção” de ESCRT-III permite que todas as subunidades associadas sejam recicladas para uso posterior. Vta1 é uma proteína dimérica contendo um domínio VSL (assim chamado porque é encontrada nas proteínas V ps4, S BP1 e L IP5), que permite a ligação a Vps4 e um domínio MIT para associação com a subunidade ESCRT-III Vps60. Embora não seja essencial, foi demonstrado que o Vta1 ajuda na montagem do anel Vps4, acelera a atividade ATPase do Vsp4 e estimula a desmontagem do ESCRT-III.
Bro1
A principal função do Bro1 é recrutar desubiquitinases para o complexo ESCRT-III. Isso resulta na remoção de marcadores de ubiquitina de proteínas direcionadas para degradação no lisossoma imediatamente antes da geração de corpos multivesiculares. Também foi especulado que o Bro1 ajuda a estabilizar o ESCRT-III enquanto os marcadores de ubiquitina são clivados das proteínas de carga.
Bro1 contém um domínio do terminal amino de Bro1 que se liga a Snf7 de ESCRT-III. Essa ligação leva Bro1 ao local de abscisão da membrana. Bro1 também se liga ao domínio catalítico de Doa4, uma ubiquitina hidrolase (desubiquitinase), trazendo-a para o local da abscisão. Doa4 remove a ubiquitina das proteínas de carga sendo direcionadas para o lisossoma.
Biogênese do corpo multivesicular e transporte de carga
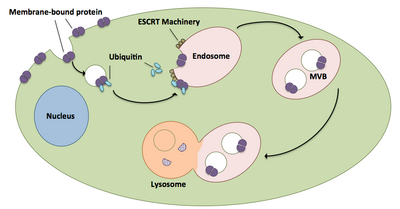
Os corpos multivesiculares desempenham um grande papel no transporte de proteínas e receptores ubiquitinados para um lisossoma. Os complexos ESCRT transportam carga ubiquitinada para vesículas celulares que brotam diretamente no compartimento endossômico da célula, formando corpos multivesiculares. Esses corpos multivesiculares eventualmente se fundem com o lisossoma, causando a degradação da carga. Uma descrição mais detalhada do processo, incluindo máquinas associadas, existe da seguinte forma:
- Os componentes Vps27 e Hse1 do ESCRT-0 ligam-se, cada um, à carga ubiquitinada.
- O Vps27 se liga ao fosfatidilinositol 3-fosfato, um lipídio endossômico, que então recruta todo o complexo para um endossomo.
- Vps27 liga a subunidade Vps23 de ESCRT-I, trazendo ESCRT-I para o endossomo. ESCRT-I também pode ligar proteínas ubiquitinadas.
- Vps36 associa-se com a subunidade ESCRT-I Vps28, resultando no recrutamento do complexo ESCRT-II.
- A subunidade Vps25 do ESCRT-II liga-se e ativa o Vps20 do complexo ESCRT-III.
- Vps20 nuclea a formação de cadeias Snf7 que são então encobertas por Vps24.
- Vps24 recruta Vps2, que traz Vps4 para o complexo.
- Vps4 forma um poro feito de dois anéis hexaméricos aos quais Vta1 se liga. Este complexo Vps4-Vta1 dispara a desmontagem do ESCRT-III e marca o fim da formação do corpo multivesicular.
Abscisão da membrana
A abscisão da membrana durante a citocinese é o processo pelo qual a membrana que conecta duas células filhas é clivada durante a divisão celular . Uma vez que é conservado em uma série de arquéias , a abscisão da membrana é considerada o papel mais antigo para o maquinário ESCRT. O processo começa quando a proteína centrossomal CEP55 é recrutada para o corpo médio das células em divisão em associação com MKLP1, uma proteína mitótica semelhante à cinesina que se associa aos microtúbulos. O CEP55 então recruta a subunidade Vps23 do ESCRT-I e a proteína acessória ALIX, que se formam em anéis em cada lado do corpo médio. ESCRT-I e ALIX recrutam ESCRT-III por meio de sua subunidade Snf7. As subunidades ESCRT-III Vps20, Snf7, Vps24, Vps2 e Did2 formam uma fibrila em forma de espiral adjacente aos anéis formados por Vps23. A formação dessa estrutura em espiral deforma a membrana e a espastina AAA-ATPase é trazida por Did2 e Ist1 para clivar os microtúbulos formados no meio do corpo. O Vps4 então catalisa a desmontagem do complexo ESCRT-III, resultando em duas células-filhas recém-separadas. O processo de abscisão da membrana foi descrito usando proteínas metazoárias, uma vez que o processo foi estudado em maior extensão em metazoários.
Brotamento viral

A liberação de partículas virais, também conhecida como brotamento viral , é um processo pelo qual os vírions livres são liberados de dentro das células por meio do sequestro da maquinaria ESCRT da célula hospedeira. Retrovírus , como o HIV-1 e o vírus linfotrópico T humano , bem como vários vírus com envelope , incluindo o vírus Ebola , requerem maquinaria ESCRT para sair da célula hospedeira. O processo é iniciado por proteínas virais gag, as principais proteínas estruturais de revestimentos retrovirais, que interagem com TSG101 do ESCRT-complexo I e a proteína ALIX acessório. As subunidades ESCRT-III (apenas CHMP4 e CHMP2 são essenciais) são recrutadas para o local do brotamento viral para contrair e cortar o colo do botão de uma maneira semelhante à descrita para a abscisão da membrana durante a citocinese. O Vps4 então recicla os componentes ESCRT-III para o citosol e o vírus é liberado da célula. O mecanismo descrito aqui utiliza proteínas de metazoários, uma vez que o brotamento viral foi estudado mais extensivamente em metazoários.


