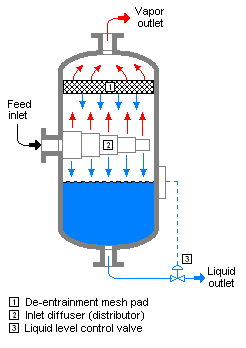
Evaporação instantânea - Flash evaporation
A evaporação instantânea (ou evaporação parcial ) é o vapor parcial que ocorre quando uma corrente de líquido saturado sofre uma redução na pressão ao passar por uma válvula de estrangulamento ou outro dispositivo de estrangulamento. Este processo é uma das operações unitárias mais simples . Se a válvula ou dispositivo de estrangulamento estiver localizado na entrada de um vaso de pressão de forma que a evaporação instantânea ocorra dentro do vaso, então o vaso é frequentemente denominado tambor de flash .
Se o líquido saturado for um líquido de um único componente (por exemplo, propano ou amônia líquida ), uma parte do líquido imediatamente "se transforma" em vapor. Tanto o vapor quanto o líquido residual são resfriados à temperatura de saturação do líquido à pressão reduzida. Isso é freqüentemente referido como "autorrrefecimento" e é a base da maioria dos sistemas convencionais de refrigeração por compressão de vapor .
Se o líquido saturado é um líquido multicomponente (por exemplo, uma mistura de propano , isobutano e butano normal ), o vapor expelido é mais rico em componentes mais voláteis do que o líquido restante.
A evaporação instantânea descontrolada pode resultar em uma explosão de vapor em expansão de líquido fervente ( BLEVE ).
Evaporação instantânea de um líquido de componente único
A evaporação instantânea de um líquido de um único componente é um processo isentálpico e costuma ser chamada de flash adiabático . A seguinte equação, derivada de um equilíbrio de calor simples em torno da válvula ou dispositivo de estrangulamento, é usada para prever quanto de um líquido de componente único é vaporizado.
Onde: = razão em peso de líquido vaporizado / massa total = entalpia de líquido a montante na temperatura e pressão a montante, J / kg
= entalpia de vapor instantâneo na pressão a jusante e
temperatura de saturação correspondente , J / kg
= entalpia de líquido residual na pressão a jusante e
temperatura de saturação correspondente , J / kg
Se os dados de entalpia necessários para a equação acima não estiverem disponíveis, a seguinte equação pode ser usada.
Onde: = fração de peso vaporizada = calor específico do líquido na temperatura e pressão a montante, J / (kg ° C) = temperatura do líquido a montante, ° C = temperatura de saturação do líquido correspondente à pressão a jusante, ° C
= calor líquido de vaporização na pressão a jusante e
temperatura de saturação correspondente , J / kg
Aqui, as palavras "a montante" e "a jusante" referem-se a antes e depois de o líquido passar pela válvula ou dispositivo de estrangulamento.
Este tipo de evaporação flash é usado na dessalinização de água salobra ou água do oceano por " Destilação Flash Multi-Stage ". A água é aquecida e então direcionada para um "estágio" de evaporação instantânea de pressão reduzida, onde parte da água se transforma em vapor. Este vapor é posteriormente condensado em água sem sal. O líquido salgado residual desse primeiro estágio é introduzido em um segundo estágio de evaporação instantânea a uma pressão mais baixa do que a pressão do primeiro estágio. Mais água é transformada em vapor, que também é posteriormente condensado em mais água sem sal. Esse uso sequencial de vários estágios de evaporação instantânea é continuado até que os objetivos do projeto do sistema sejam atendidos. Uma grande parte da capacidade de dessalinização instalada no mundo usa destilação flash de vários estágios. Normalmente, essas plantas têm 24 ou mais estágios sequenciais de evaporação instantânea.
Flash de equilíbrio de um líquido multicomponente
O flash de equilíbrio de um líquido multicomponente pode ser visualizado como um processo de destilação simples usando um único estágio de equilíbrio . É muito diferente e mais complexo do que a evaporação instantânea de um líquido de componente único. Para um líquido multicomponente, calcular as quantidades de vapor evaporado e líquido residual em equilíbrio entre si a uma dada temperatura e pressão requer uma solução iterativa de tentativa e erro . Esse cálculo é comumente referido como cálculo de equilíbrio instantâneo. Envolve resolver a equação de Rachford-Rice :
Onde:
- z i é a fração molar do componente i no líquido de alimentação (presume-se que seja conhecido);
- β é a fração da alimentação que é vaporizada;
- K i é a constante de equilíbrio do componente i .
As constantes de equilíbrio K i são, em geral, funções de muitos parâmetros, embora o mais importante seja indiscutivelmente a temperatura; eles são definidos como:
Onde:
- x i é a fração molar do componente i na fase líquida;
- y i é a fração molar do componente i na fase gasosa.
Uma vez que a equação de Rachford-Rice foi resolvida para β , as composições x i e y i podem ser calculadas imediatamente como:
A equação de Rachford-Rice pode ter várias soluções para β , no máximo uma das quais garante que todos os x i e y i serão positivos. Em particular, se houver apenas um β para o qual:
então que β é a solução; se houver vários β 's, isso significa que K max <1 ou K min > 1, indicando respectivamente que nenhuma fase gasosa pode ser sustentada (e, portanto, β = 0) ou, inversamente, que nenhuma fase líquida pode existir (e, portanto, β = 1).
É possível usar o método de Newton para resolver a equação acima da água, mas existe o risco de convergir para o valor errado de β ; é importante inicializar o solucionador com um valor inicial sensível, como ( β max + β min ) / 2 (que, no entanto, não é suficiente: o método de Newton não oferece garantia de estabilidade) ou, alternativamente, use um solucionador de colchetes, como o método da bissecção ou o método de Brent , que têm garantia de convergência, mas podem ser mais lentos.
O flash de equilíbrio de líquidos de múltiplos componentes é amplamente utilizado em refinarias de petróleo , plantas petroquímicas e químicas e plantas de processamento de gás natural .
Contraste com secagem por spray
A secagem por spray às vezes é vista como uma forma de evaporação instantânea. No entanto, embora seja uma forma de evaporação de líquido, é bastante diferente da evaporação instantânea.
Na secagem por pulverização, uma pasta de sólidos muito pequenos é rapidamente seca por suspensão em um gás quente. A lama é primeiro atomizada em gotículas líquidas muito pequenas que são então pulverizadas em uma corrente de ar quente e seco. O líquido evapora rapidamente, deixando um pó seco ou grânulos sólidos secos. O pó seco ou grânulos sólidos são recuperados do ar de exaustão usando ciclones , filtros de mangas ou precipitadores eletrostáticos .
Evaporação natural de flash
A vaporização instantânea natural ou deposição instantânea pode ocorrer durante os terremotos, resultando na deposição de minerais mantidos em soluções supersaturadas , às vezes até minério valioso no caso de águas auríferas com ouro. Isso ocorre quando blocos de rocha são rapidamente puxados e afastados uns dos outros por falhas de jog .
Veja também
Referências
links externos
- Vapor e Flash Steam Animação, fotos e explicação técnica da diferença entre Flash Steam e fração vaporizada.
- Tutorial do Flash Steam Os benefícios de recuperar o vapor do flash, como isso é feito e as aplicações típicas.
- Tecnologias de dessalinização de água no Oriente Médio e Ásia Ocidental
- Discussão sobre secagem por pulverização
- Programa de evaporação instantânea online Destilação instantânea dos compostos de hidrocarbonetos.