Fluoração por tetrafluoreto de enxofre - Fluorination by sulfur tetrafluoride
A fluoração por tetrafluoreto de enxofre produz compostos organofluorados a partir de compostos orgânicos oxidados, incluindo álcoois, compostos de carbonila, halogenetos de alquila e outros.
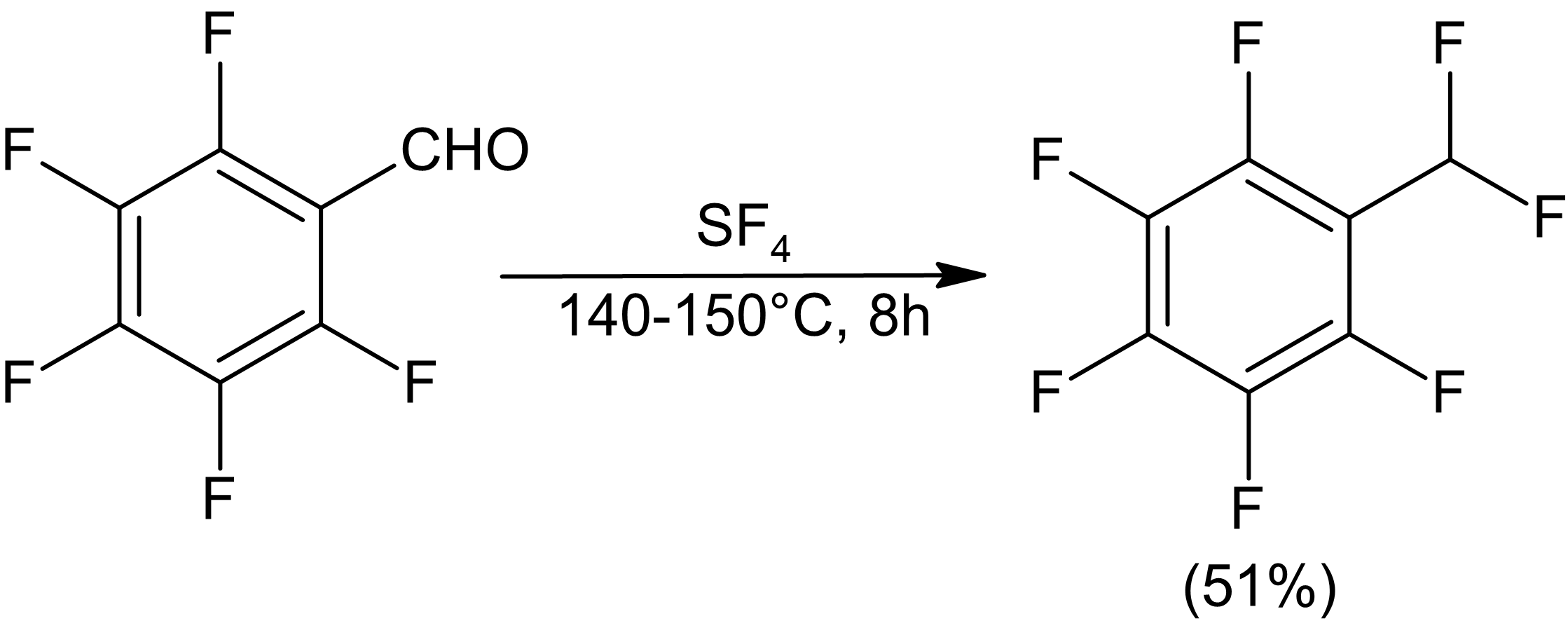
O tetrafluoreto de enxofre é um reagente gasoso que pode ser usado para fluoretar uma variedade de grupos funcionais orgânicos, incluindo compostos carbonílicos, álcoois e halogenetos. O tratamento de compostos de carbonila geralmente os converte em organofluoretos de estado de oxidação equivalente: os ácidos carboxílicos são convertidos em compostos trifluorometil, cetonas e aldeídos em difluoretos, etc. A reação tem amplo escopo e é um dos poucos métodos disponíveis para a introdução direta de flúor em um local específico sob condições relativamente suaves.
(1)
Fluorações de álcoois e halogenetos também são possíveis com SF 4 . No entanto, o SF 4 é gasoso à temperatura ambiente, e muitas transformações envolvendo esse reagente requerem temperaturas elevadas, tornando o manuseio um tanto difícil. Além disso, a reação gera grandes quantidades de fluoreto de hidrogênio . Essas preocupações levaram ao desenvolvimento de reagentes de fluoração mais seguros e robustos, como o DAST ( trifluoreto de dietilaminoenxofre ).
Mecanismo e estereoquímica
Mecanismo Prevalecente
O mecanismo de fluoração por SF 4 é incerto e varia entre os substratos. Originalmente, trifluoretos de alcoxissulfur foram propostos como intermediários; no entanto, as reações de trifluoretos de alcoxissulfur isolados com fluoreto de hidrogênio ou aquecimento não forneceram os fluoretos de alquil correspondentes.
(2)
O mecanismo de difluoração de dióis vicinais foi bem estabelecido e prossegue por ataque inverso em um grupo hidroxila para dar um intermediário fluorossulfito, que é convertido no produto difluorado após um tratamento adicional de SF 4 e HF. A segunda fluoração prossegue com a retenção da configuração. A liberação intramolecular de flúor é possível aqui e foi observada em alguns outros casos de fluoração com SF 4 . Os mecanismos S N 1 são operativos para compostos que formam carbocations facilmente, enquanto as reações S N 2 ocorrem com compostos menos ionizáveis.
(3)
A fluoração de ácidos carboxílicos dá não apenas os compostos trifluorometil esperados, mas também éteres α-tetrafluorados. Um mecanismo para contabilizar ambos os produtos foi proposto e apoiado experimentalmente. A distribuição intramolecular de flúor foi invocada para explicar a formação de cátions difluorometil. O ataque de uma molécula de fluoreto de acila em um cátion difluorometil, seguido por neutralização com bifluoreto gerado in situ , leva a produtos de éter α-tetrafluorado. A reação direta com bifluoreto fornece produtos contendo trifluorometil.
(4)
Escopo e limitações
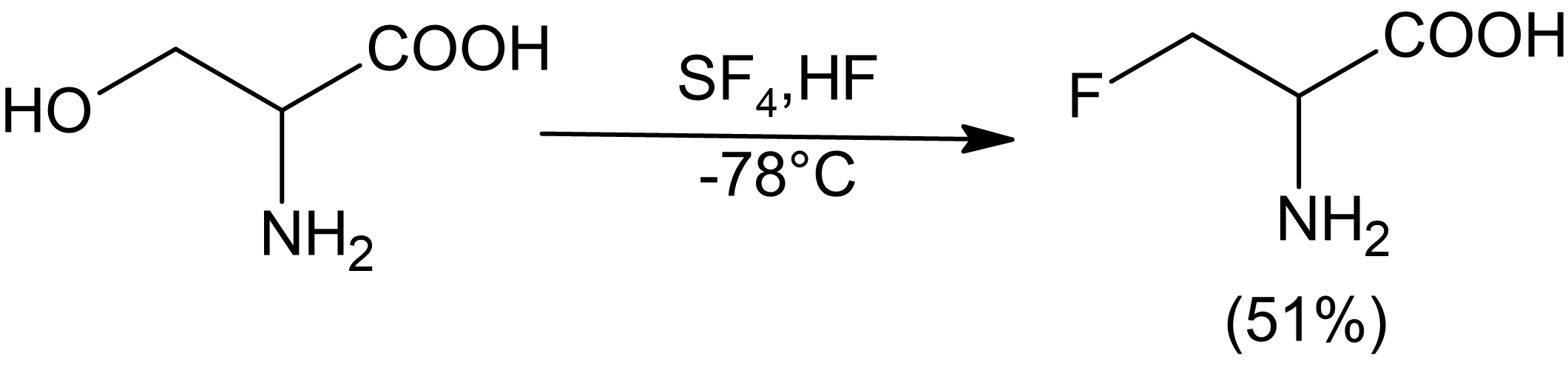
O tetrafluoreto de enxofre pode ser usado para substituir uma variedade de grupos funcionais por derivados parcial ou totalmente fluorados. O fluoreto de hidrogênio líquido pode ser usado como solvente e catalisador com SF 4 para fluoretar seletivamente os álcoois. A reatividade do SF 4 com compostos carbonílicos não é aumentada na presença de HF. Geralmente, apenas álcoois relativamente ácidos podem ser fluorados eficientemente com SF 4 , embora os aminoálcoois pareçam ser uma exceção a essa regra.
(5)
Quando dióis vicinais são combinados com SF 4 , a difluoração ocorre com inversão de configuração em um dos álcoois. Isto foi demonstrado na síntese de meso -difluorossuccinato a partir de (L) -tartrato e na síntese de (D) - e (L) -difluorossuccinato a partir de meso- tartarato.
(6)
Compostos carbonil geralmente reagem com SF 4 para produzir difluoretos geminais. Os tempos de reação tendem a ser da ordem de horas e os rendimentos são moderados.
(7)
A fluoração das lactonas pode fornecer fluoretos heterocíclicos, embora a abertura do anel tenha sido observada para a γ-butirolactona. O lactídeo de seis membros não experimenta a abertura do anel.
(8)
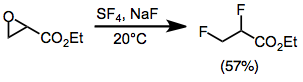
A fluoração abre os epóxidos para dar difluoretos geminais ou vicinais na maioria dos casos. Monoarlepóxidos fornecem produtos geminais com migração do grupo arila. Os rendimentos são baixos para epóxidos di e trissubstituídos estericamente impedidos. Os epóxidos substituídos com um grupo éster dão difluoretos vicinais por meio de um intermediário trifluoreto de alcoxissulfur.
(9)
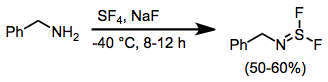
Quando as aminas são tratadas com SF 4 e uma base, resultam em difluoretos de iminossulfur. A reação posterior desses compostos com fluoretos de metal alcalino leva a sulfetos de nitrila , que sofrem cicloadição [3 + 2] na presença de dipolarófilos.
(10)
Os ácidos carboxílicos reagem com SF 4 para fornecer compostos trifluorometil através da intermediação de um fluoreto de acila. Os éteres tetrafluoroalquílicos também se formam por meio da reação entre o cátion difluorometil e o fluoreto de acila.
(11)
O tetrafluoreto de enxofre pode ser usado para fluoretar polímeros de maneira eficiente. Isso geralmente tem um efeito profundo nas propriedades do polímero - a fluoração do álcool polivinílico, por exemplo, melhora sua resistência a ácidos e bases fortes.
Aplicações Sintéticas
A síntese de uma prostaglandina contendo um grupo trifluorometil em C-16 é baseada em um intermediário obtido por fluoração de um ácido carboxílico com tetrafluoreto de enxofre.
(12)
Comparação com outros métodos
Os métodos modernos de fluoração tornaram o tetrafluoreto de enxofre essencialmente obsoleto. A utilização do reagente de DAST mais facilmente manuseados ( trifluoreto de dietilaminoenxofre ) é agora preferida para SF 4 para reacções de fluoração nucleof ilicos. O DAST é mais seletivo na fluoração de álcoois e promove menos rearranjos e eliminações em substratos sensíveis a ácidos. O inconveniente de manusear SF 4 gasoso é uma desvantagem das fluorações que empregam este reagente. Além disso, a funcionalidade ácido-lábil não pode estar presente no substrato se o HF for usado. Reagentes de fluoração eletrofílicos, como Selectfluor e N- fluorossulfonimidas, complementam a reatividade do SF 4 e evitam esses problemas.
(13)
Condições Experimentais e Procedimento
Condições Típicas
O tetrafluoreto de enxofre é um gás incolor à temperatura ambiente, embora ferva a -38 ° C. É rapidamente hidrolisado em meio aquoso e é corrosivo e tóxico; portanto, as reações devem ser realizadas em uma capela bem ventilada com luvas e óculos de proteção. O tetrafluoreto de enxofre não reage com o aço inoxidável, cobre ou níquel. Normalmente, as reações de fluoração com SF 4 são realizadas em um aparelho agitador de aço inoxidável. Os reagentes gasosos são introduzidos no agitador por condensação e os produtos gasosos são geralmente liberados quando a reação está completa (a menos que os produtos gasosos sejam de interesse, caso em que podem ser condensados em um recipiente separado). O fluoreto de hidrogênio pode ser separado dos produtos desejados vertendo a mistura de reação em água seguido por filtração. Soluções de hidróxido de cálcio também podem ser usadas neste contexto, produzindo fluoreto de cálcio inofensivo .
Procedimento de Exemplo
(14)
O dicloridrato de 5-hidroxi-histamina (1700 mg, 3,5 mmol) foi dissolvido em 25 mL de HF líquido anidro e a solução foi evaporada em uma corrente de nitrogênio seco para remover o HCl. O resíduo foi redissolvido em 40 ml de HF a -78 "C, tratou-se com 2,3 mL de SF 4 (40,3 mmol), e aqueceu-se a 0" C durante 2,5 h. Depois de se arrefecer novamente para -78 "C, um adicional de 2 mL de SF 4 foi condensado na solução. O reactor foi então imerso num banho de gelo (cerca de 1 L), que foi deixada a aquecer até à temperatura ambiente durante a noite. O HF foi então removido numa corrente de N 2 , o resíduo foi dissolvido em 25 mL de HCl 2,5 N, e a solução foi concentrada in vácuo para um resíduo gomoso. Este foi aplicado a 150 ml de resina Dowex 50X8 e eluiu-se com 200 mL de H 2 o , 400 mL de HCl 1 N, e cerca de 1L de HCl 2,5 N. As frações positivas de ninidrina (HCl 2,5 N) foram concentradas em 500 mg de dicloridrato de B-fluorohistamina cristalino (71%): decomposição a 130 ° C quando inserido em esta temperatura; 60 MHz 1 H NMR (D 2 O-DCl) δ 3,3-4,2 (multipleto largo, 2 H), 6,27 (dupleto de multipletos de quatro linhas, 1 H, J HF = 47 Hz), 7,83 (m , 1 H, J HF = 2 Hz), 9,0 (s, 1 H). Anal. Calc. Para C 5 H 10 N 3 FCl 2 : C, 29,70; H, 4,95; N, 20,80; F, 9,40 . Encontrado: C, 29,69; H, 4,94; N, 20,51; F, 9,72.