Abordagem primeiro genótipo - Genotype-first approach
A abordagem de primeiro genótipo é um tipo de estratégia usada em estudos epidemiológicos genéticos para associar genótipos específicos a fenótipos clínicos aparentes de uma doença ou característica complexa. Ao contrário de “primeiro o fenótipo”, a estratégia tradicional que tem guiado os estudos de associação do genoma (GWAS) até agora, esta abordagem caracteriza os indivíduos primeiro por um genótipo estatisticamente comum com base em testes moleculares anteriores à classificação fenotípica clínica. Este método de agrupamento leva a avaliações de pacientes com base em uma etiologia genética compartilhada para os fenótipos observados, independentemente de sua suspeita de diagnóstico. Assim, essa abordagem pode prevenir o viés fenotípico inicial e permitir a identificação de genes que representam uma contribuição significativa para a etiologia da doença .
Esta abordagem não é afetada pela heterogeneidade fenotípica, penetrância incompleta e níveis de expressividade. Portanto, é útil em doenças complexas que também se sobrepõem, como transtorno do espectro do autismo e deficiência intelectual , permitindo distinguir as doenças e determinar subtipos específicos da doença com base no conteúdo genômico .
Atualmente, a abordagem genótipo primeiro é usada principalmente para objetivos de pesquisa. No entanto, as implicações desses estudos podem ter aplicações clínicas valiosas, incluindo diagnóstico aprimorado, aconselhamento e grupos de apoio para indivíduos com a mesma etiologia genética.
Fundo
Inicialmente, a ideia de identificar o genótipo de indivíduos e, subsequentemente, seu (s) fenótipo (s) associado (s) foi usada pela primeira vez nos primeiros estudos citogenéticos . Por volta de 1960, a descoberta da Trissomia 21 levou à compreensão de que a genética poderia ser usada para prever o (s) fenótipo (s). Das décadas de 1960 a 1990, técnicas citogenéticas, como bandeamento cromossômico e hibridização in situ fluorescente (FISH), foram utilizadas para identificar e caracterizar fenotipicamente os pacientes com anormalidades cromossômicas.
Doenças e características complexas apresentam muitas dificuldades para os estudos epidemiológicos devido à sua natureza como doenças multifatoriais. Mais de um gene pode ser a base de uma doença complexa e geralmente contribui com um efeito menor do que o observado em doenças monogênicas ( doenças mendelianas ). Além disso, muitas dessas doenças complexas exibem diversos fenótipos, bem como uma ampla gama de expressividade e penetrância. Os genes também podem ser pleiotrópicos , sendo responsáveis por muitos fenótipos clínicos aparentemente distintos. Esses recursos limitam a capacidade de pesquisas e estudos clínicos para designar genes causais ou variantes para os fenótipos observados e para classificar distúrbios.
Os médicos estão começando a reconhecer a necessidade de classificar as doenças genômicas por um genótipo comum, em vez de um fenótipo comum, e como a abordagem do primeiro genótipo pode beneficiar esse propósito.
Métodos
Vários métodos podem ser usados com uma abordagem genótipo primeiro, no entanto, as seguintes etapas são geralmente incluídas:
- Estabelecimento de uma população de estudo e genotipagem
- Análise de variantes genômicas de interesse encontradas na população do estudo
- As populações de estudo são montadas com base no genótipo
- Associação de genótipo a fenótipo (s) dentro do respectivo grupo
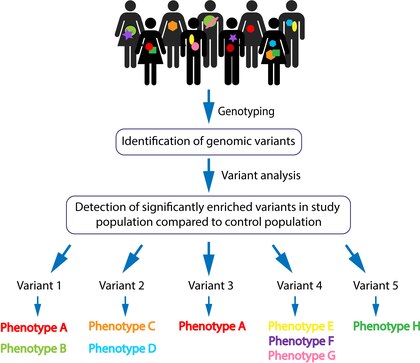
A genotipagem é gerada usando tecnologias de sequenciamento de próxima geração (incluindo sequenciamento de todo o genoma e sequenciamento de exoma ) e análises de microarranjos . Os dados brutos são então analisados estatisticamente quanto à frequência das variantes com base na população. Variantes comuns são filtradas e a patogenicidade é determinada por meio de implicações genéticas previstas. Essas etapas permitem a identificação de variantes supostamente altamente penetrantes e seu locus específico . As variantes selecionadas geralmente são sequenciadas novamente para validação (por sequenciamento Sanger direcionado ). Variantes genômicas validadas podem então ser analisadas para recorrências entre os indivíduos afetados dentro da coorte. A patogenicidade de uma variante genômica é estatisticamente baseada em sua presença significativamente abundante nos indivíduos afetados em comparação com os indivíduos não afetados, não exclusivamente na deletéria da variante. Uma variante candidata pode então ser associada a um fenótipo compartilhado com a aspiração de que quanto mais pacientes exibindo a mesma variante com o mesmo fenótipo forem identificados, uma associação mais forte pode ser feita. Finalmente, o delineamento é feito entre uma variante específica para fenótipos clínicos associados [Figura 1].
Implicações clínicas e exemplos
A abordagem genótipo primeiro tem sido usada para diagnosticar pacientes com doenças raras, identificar novas associações genótipo-fenótipos de doenças e caracterizar doenças incomuns ou heterogêneas com base no genótipo do paciente. Em 2014, a abordagem genótipo primeiro foi usada para avaliar variantes raras e de baixa frequência na população finlandesa. Como a população finlandesa está isolada e recentemente passou por um gargalo populacional, em relação a outros países, isso oferece dois benefícios principais para estudos de primeiro genótipo. Variantes deletérias são encontradas em frequências mais altas dentro de um espectro menor de variantes raras em populações de fundadores com gargalos. Ao comparar as variantes encontradas usando o sequenciamento de exoma completo (WES) na população finlandesa com o WES de um grupo de controle de europeus não finlandeses, as variantes de perda de função (LOF) foram observadas com maior frequência na população finlandesa. Os fenótipos de indivíduos finlandeses com essas variantes LOF foram então analisados para determinar novas associações genótipo-fenótipo. Essas associações detectadas incluíam uma que poderia ser letal embrionária, informação que pode não ter sido descoberta em pesquisas usando uma abordagem de primeiro fenótipo. Além disso, os pesquisadores também descobriram novas variantes de splice no gene LPA que reduzem os níveis de apolipoproteína A e oferecem um fenótipo protetor contra doenças cardiovasculares.
A avaliação primeiro com o genótipo está se tornando a abordagem padrão para o diagnóstico clínico de doenças heterogêneas complexas. As síndromes de microduplicação e microdeleção têm uma variedade de características, incluindo deficiência intelectual e atraso no desenvolvimento , que variam em gravidade, tornando os pacientes com essas síndromes muito difíceis de diagnosticar. Desde o desenvolvimento de tecnologias de sequenciamento de próxima geração, os médicos têm sido capazes de usar uma abordagem genotípica para agrupar esses pacientes com base em sua microdeleção ou duplicação e documentar as características da doença presentes nesses grupos. A análise de microarranjos cromossômicos, em particular, está sendo usada clinicamente para auxiliar no diagnóstico de pacientes com síndromes de microdeleção e microdulplicação. Em doenças, como o transtorno do espectro do autismo (TEA), em que a diferenciação de pacientes em grupos de subtipos de doenças com base no fenótipo é um desafio, os estudos de genótipo permitem a classificação de pacientes em subtipos com base em sua genética. Isso, por sua vez, dará uma maior compreensão das causas genéticas do TEA e poderá, no futuro, definir subtipos específicos de TEA para os pacientes serem diagnosticados.
A pesquisa com base no genótipo, por meio da identificação de novos genes associados a doenças, também pode beneficiar as empresas farmacêuticas e o desenvolvimento de medicamentos. Para doenças complexas, usando a associação do primeiro gene do fenótipo, o desenvolvimento de terapêuticas é frequentemente malsucedido devido a vários genes que contribuem para uma doença. Com associações de genótipo primeiro, o alvo terapêutico potencial é identificado primeiro.
Vantagens e limitações
Vantagens
- Uma mudança no sentido de caracterizar os indivíduos por um genótipo comum, em vez da apresentação clínica, permitirá a classificação de novas síndromes e a classificação genética de certos subtipos de doença, à medida que o sequenciamento se torna mais barato, rápido e eficiente.
- A herança de uma variante genômica de um pai saudável não resultaria em sua exclusão da análise de variante, sendo responsável pelo papel dos modificadores no resultado fenotípico.
- Esta abordagem não é afetada pela heterogeneidade fenotípica, penetrância incompleta e expressividade.
- Essa abordagem contribui para o estudo da expressividade, pleiotropia e mutações esporádicas.
- Esta abordagem examina mutações altamente penetrantes que estão associadas à doença, independentemente da origem genética.
- A fenotipagem abrangente e detalhada é possível mesmo com um pequeno número de pacientes com etiologia genética comum.
- Essa abordagem pode identificar apresentações atípicas da doença quando usada para diagnóstico.
Limitações
- O fenótipo pode mudar com o tempo (por exemplo, torna-se mais grave, alteração na localização física), tornando os estudos iniciais do genótipo uma suposição sobre o papel da variante na manifestação da doença em um ponto de tempo específico. Portanto, o acompanhamento longitudinal é importante para que a associação genótipo-fenótipo seja avaliada com o tempo e examine o prognóstico da doença.
- Variantes identificadas que podem contribuir para um fenótipo leve, ou para uma gama de fenótipos, não seriam benéficas na determinação do diagnóstico e prognóstico. No entanto, no futuro, à medida que mais subtipos de doenças são classificados, os fenótipos leves podem ter mais relevância.
- A associação genótipo-fenótipo depende da apresentação de fenótipos clinicamente reconhecíveis.
- Como visto em outros estudos de associação de genoma, essa abordagem pode gerar variantes de significado desconhecido , especialmente quando usada para diagnóstico.
Veja também
- Doença complexa
- Estudo de associação de todo o genoma (GWAS)
- Microarray
- Sequenciamento completo do exoma (WES)
- Sequenciamento do genoma inteiro (WGS)