Lipase hepática - Hepatic lipase
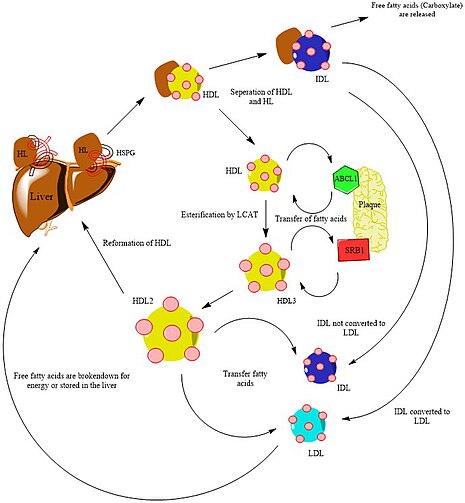
A lipase hepática (HL) , também chamada de lipase triglicerídeo hepática (HTGL) ou LIPC (para "lipase, hepática"), é uma forma de lipase , catalisando a hidrólise do triacilglicerídeo . A lipase hepática é codificada pelo cromossomo 15 e seu gene também é frequentemente denominado HTGL ou LIPC. A lipase hepática é expressa principalmente nas células do fígado, conhecidas como hepatócitos, e nas células endoteliais do fígado. A lipase hepática pode permanecer ligada ao fígado ou pode se desvincular das células endoteliais do fígado e pode entrar no sistema circulatório do corpo. Quando ligado às células endoteliais do fígado, é freqüentemente encontrado ligado a HSPG, heparan sulfato proteoglicanos (HSPG), mantendo HL inativo e incapaz de se ligar a HDL (lipoproteína de alta densidade) ou IDL (lipoproteína de densidade intermediária). Quando está livre na corrente sanguínea, entretanto, encontra-se associado ao HDL para mantê-lo inativo. Isso ocorre porque os triacilglicerídeos no HDL servem como substrato, mas a lipoproteína contém proteínas em torno dos triacilglicerídeos que podem impedir que os triacilglicerídeos sejam quebrados pelo HL.
Uma das principais funções da lipase hepática é converter a lipoproteína de densidade intermediária (IDghggL) em lipoproteína de baixa densidade (LDL). A lipase hepática, portanto, desempenha um papel importante na regulação do nível de triglicerídeos no sangue, mantendo níveis estáveis de IDL, HDL e LDL.
Função
A lipase hepática se enquadra em uma classe de enzimas conhecidas como hidrolases . Sua função é hidrolisar o triacilglicerol em diacilglicerol e carboxilato (ácidos graxos livres) com a adição de água. O substrato, o triacilglicerol , vem da IDL ( lipoproteína de densidade intermediária ) e a liberação de ácidos graxos livres converte a IDL em LDL ( lipoproteína de baixa densidade ). Esses remanescentes de LDL podem ser enviados de volta ao fígado, onde podem ser armazenados para uso posterior ou decompostos para aproveitar sua energia. Ele também pode ser enviado para células periféricas para seu colesterol e usado em vias anabólicas para construir moléculas de que a célula precisa, como hormônios que incluem uma espinha dorsal de colesterol.
Para prevenir o acúmulo de placa (também conhecido como pool de lipídios), as moléculas nascentes de HDL com baixo teor de triglicerídeos retiram os ácidos graxos livres das placas com a ajuda das proteínas ABCL1. Essas proteínas ajudam a transferir ácidos graxos livres das placas nas artérias para o HDL. Este processo cria HDL3 (lipoproteína de alta densidade 3), uma molécula HDL madura que foi esterificada por outra enzima conhecida como LCAT. Mais ácidos graxos livres podem ser retirados da placa pelos receptores SR-B1, que convertem HDL3 em HDL2, que contém concentrações mais altas de ácidos graxos livres. O HDL2 pode então interagir com o LDL e o IDL, transferindo-se para os ácidos graxos que se acumularam na placa. A lipase hepática pode então catalisar a conversão de IDL em LDL ao quebrar os triacilglicerídeos em IDL e liberar ácidos graxos livres para serem usados por outras células com baixas concentrações de colesterol ou armazenados no fígado para uso posterior.
Regulação da lipase hepática
O corpo humano contém duas formas inativas de LH. Uma forma inativa é encontrada no fígado ligada a HSPG (proteoglicanos de sulfato de heparina) e a segunda forma inativa é encontrada no sangue ligada a HDL, inativada pelas proteínas na superfície da lipoproteína. A ativação do HL ocorre em duas etapas. Primeiro, o HDL que chega ao fígado se liga ao HL, removendo assim o proteoglicano de heparan sulfato e liberando a lipase hepática na corrente sanguínea, mas o HL ainda é inativo devido às proteínas na superfície da lipoproteína. Em segundo lugar, o HDL se desassocia do HL para ativar as enzimas HL no sangue.
Descobriu-se que o HDL é regulado por interações eletrostáticas com lipoproteínas como o HDL. Quando o HDL absorve os ácidos graxos livres das células para evitar o acúmulo de placa, ele começa a aumentar sua carga negativa geral e, em vez disso, estimula o HL a catalizar os triacilglicerídeos dentro da VLDL (lipoproteína de densidade muito baixa). Isso ocorre porque o acúmulo de carga negativa em HDL inibe a ligação, mas permitirá que HL catalise outras lipoproteínas. Outras lipoproteínas, como ApoE, funcionam de maneira semelhante inibindo a ligação de HL e HDL, mas permitirão que HL catalise outras lipoproteínas.
Outros fatores que contribuem para a regulação da PA são decorrentes das diferenças de sexo entre mulheres e homens. Foi demonstrado que as mulheres contêm níveis mais baixos de ApoE junto com uma quantidade aumentada de enzimas HL livres em seu sistema circulatório quando comparadas aos homens. Acredita-se também que a produção de estrogênio em mulheres reduz a atividade do HL por servir como um inibidor da transcrição do gene.
A secreção de HDL do fígado para o sistema circulatório regula a liberação de HL na corrente sanguínea do corpo. Isso ocorre porque os fatores que aumentam a liberação de HDL (como o jejum, levando a níveis baixos de HDL) aumentam a quantidade de HL ligada ao HDL e liberada na corrente sanguínea. Outra lipoproteína, ApoA-I, que aumenta a liberação de HDL, demonstrou ter um efeito semelhante ao transformar o gene que a codificava. A proteína ApoA-I mutada causou uma diminuição na liberação de HL e, portanto, diminuiu a quantidade de HL ligada a HDL e liberada na corrente sanguínea.
Significado clínico
A deficiência de lipase hepática é uma doença autossômica recessiva rara que resulta em colesterol elevado de lipoproteína de alta densidade (HDL) devido a uma mutação no gene da lipase hepática. As características clínicas não são bem compreendidas e não há xantomas característicos . Existe uma associação com um atraso na aterosclerose em um modelo animal.
Em muitos estudos realizados, a lipase hepática também está intimamente relacionada à obesidade. Em um teste, um experimento foi criado por Cedó et al. onde células de camundongo foram criadas para ter uma proteína HL mutada que perdeu sua função. Eles descobriram que o aumento dos níveis de triglicerídeos leva à doença hepática gordurosa não-alcoólica. Isso se deveu à incapacidade de HL de converter os triacilglicerídeos em IDL e, assim, criar o LDL. Assim, a incapacidade das células endoteliais de absorver ácidos graxos livres torna-se maior e mais IDL é armazenado no fígado. Essa deficiência de HL também leva a problemas de inflamação do fígado e obesidade. No experimento, porém, o que deve ser observado é que HL de camundongo é encontrado não ligado a proteoglicanos de sulfato de heparano (HSPG), enquanto HL humano é encontrado ligado a proteoglicanos de sulfato de heparano (HSPG), desativando HL até se ligar a IDL. Mais experimentos devem ser realizados para determinar os efeitos potenciais em humanos.
Referências
Leitura adicional
- Santamarina-Fojo S, Haudenschild C, Amar M (junho de 1998). "O papel da lipase hepática no metabolismo das lipoproteínas e aterosclerose". Opinião Atual em Lipidologia . 9 (3): 211–9. doi : 10.1097 / 00041433-199806000-00005 . PMID 9645503 .
- Jansen H, Verhoeven AJ, Sijbrands EJ (setembro de 2002). "Lipase hepática: uma proteína pró ou anti-aterogênica?" . Journal of Lipid Research . 43 (9): 1352–1362. doi : 10.1194 / jlr.R200008-JLR200 . PMID 12235167 .
- Zambon A, Deeb SS, Pauletto P, Crepaldi G, Brunzell JD (abril de 2003). "Lipase hepática: um marcador de risco de doença cardiovascular e resposta à terapia". Opinião Atual em Lipidologia . 14 (2): 179–89. doi : 10.1097 / 00041433-200304000-00010 . PMID 12642787 . S2CID 23377060 .
- Hegele RA, Tu L, Connelly PW (1993). "Mutações e polimorfismos da lipase hepática humana". Mutação Humana . 1 (4): 320–4. doi : 10.1002 / humu.1380010410 . PMID 1301939 . S2CID 45428213 .
- Hegele RA, Vezina C, Moorjani S, Lupien PJ, Gagne C, Brun LD, Little JA, Connelly PW (março de 1991). "Uma mutação do gene da lipase hepática associada à deficiência lipolítica hereditária". The Journal of Clinical Endocrinology and Metabolism . 72 (3): 730–2. doi : 10.1210 / jcem-72-3-730 . PMID 1671786 .
- Hegele RA, Little JA, Connelly PW (agosto de 1991). "Composto de heterozigosidade para lipase hepática mutante na deficiência de lipase hepática familiar". Comunicações de pesquisa bioquímica e biofísica . 179 (1): 78–84. doi : 10.1016 / 0006-291X (91) 91336-B . PMID 1883393 .
- Ameis D, Stahnke G, Kobayashi J, McLean J, Lee G, Büscher M, Schotz MC, Will H (abril de 1990). "Isolamento e caracterização do gene da lipase hepática humana" . The Journal of Biological Chemistry . 265 (12): 6552–5. doi : 10.1016 / S0021-9258 (19) 39182-3 . PMID 2324091 .
- Datta S, Luo CC, Li WH, VanTuinen P, Ledbetter DH, Brown MA, Chen SH, Liu SW, Chan L (janeiro de 1988). "Lipase hepática humana. Sequência de cDNA clonada, polimorfismos de comprimento de fragmento de restrição, localização cromossômica e relações evolutivas com lipase de lipoproteína e lipase pancreática" . The Journal of Biological Chemistry . 263 (3): 1107–10. doi : 10.1016 / S0021-9258 (19) 57271-4 . PMID 2447084 .
- Cai SJ, Wong DM, Chen SH, Chan L (novembro de 1989). "Estrutura do gene da lipase triglicerídeo hepática humana". Bioquímica . 28 (23): 8966–71. doi : 10.1021 / bi00449a002 . PMID 2605236 .
- Stahnke G, Sprengel R, Augustin J, Will H (1988). "Lipase triglicerídeo hepática humana: clonagem de cDNA, sequência de aminoácidos e expressão em uma linha de células em cultura". Diferenciação; Pesquisa em Diversidade Biológica . 35 (1): 45–52. doi : 10.1111 / j.1432-0436.1987.tb00150.x . PMID 2828141 .
- Martin GA, Busch SJ, Meredith GD, Cardin AD, Blankenship DT, Mao SJ, Rechtin AE, Woods CW, Racke MM, Schafer MP (agosto de 1988). "Isolation and cDNA sequence of human postheparin plasma hepatic triglyceride lipase" . The Journal of Biological Chemistry . 263 (22): 10907–14. doi : 10.1016 / S0021-9258 (18) 38056-6 . PMID 2839510 .
- Sparkes RS, Zollman S, Klisak I, Kirchgessner TG, Komaromy MC, Mohandas T, Schotz MC, Lusis AJ (outubro de 1987). "Genes humanos envolvidos na lipólise de lipoproteínas do plasma: mapeamento de loci para lipase de lipoproteína para 8p22 e lipase hepática para 15q21". Genômica . 1 (2): 138–44. doi : 10.1016 / 0888-7543 (87) 90005-X . PMID 3692485 .
- Kounnas MZ, Chappell DA, Wong H, Argraves WS, Strickland DK (abril de 1995). "A internalização celular e a degradação da lipase hepática são mediadas por proteínas relacionadas ao receptor de lipoproteínas de baixa densidade e requerem proteoglicanos da superfície celular" . The Journal of Biological Chemistry . 270 (16): 9307–12. doi : 10.1074 / jbc.270.16.9543 . PMID 7721852 .
- Mori A, Takagi A, Ikeda Y, Ashida Y, Yamamoto A (agosto de 1996). "Um polimorfismo AvaII no exon 5 do gene da lipase triglicerídeo hepática humana". Molecular and Cellular Probes . 10 (4): 309–11. doi : 10.1006 / mcpr.1996.0040 . PMID 8865179 .
- Takagi A, Ikeda Y, Mori A, Ashida Y, Yamamoto A (agosto de 1996). "Identification of a BstNI polymorphism in exon 9 of the human hepatic triglyceride lipase gene". Molecular and Cellular Probes . 10 (4): 313–4. doi : 10.1006 / mcpr.1996.0041 . PMID 8865180 .
- Choi SY, Goldberg IJ, Curtiss LK, Cooper AD (agosto de 1998). "A interação entre ApoB e a lipase hepática medeia a captação de lipoproteínas contendo ApoB" . The Journal of Biological Chemistry . 273 (32): 20456–62. doi : 10.1074 / jbc.273.32.20456 . PMID 9685400 .
- Cargill M, Altshuler D, Ireland J, Sklar P, Ardlie K, Patil N, Shaw N, Lane CR, Lim EP, Kalyanaraman N, Nemesh J, Ziaugra L, Friedland L, Rolfe A, Warrington J, Lipshutz R, Daley GQ , Lander ES (julho de 1999). "Caracterização de polimorfismos de nucleotídeo único em regiões codificantes de genes humanos". Nature Genetics . 22 (3): 231–8. doi : 10.1038 / 10290 . PMID 10391209 . S2CID 195213008 .
- Tiebel O, Gehrisch S, Pietzsch J, Gromeier S, Jaross W (2000). "Inserção / duplicação de 18 bp com mutação missense interna no exon 3 do gene da lipase hepática humana. Mutações resumidas no. 181. Online". Mutação Humana . 12 (3): 216. PMID 10660332 .
- Yamakawa-Kobayashi K, Somekawa Y, Fujimura M, Tomura S, Arinami T, Hamaguchi H (maio de 2002). "Relação do polimorfismo -514C / T no gene da lipase hepática com os níveis de colesterol HDL e LDL em mulheres pós-menopáusicas sob terapia de reposição hormonal". Aterosclerose . 162 (1): 17–21. doi : 10.1016 / S0021-9150 (01) 00675-X . PMID 11947893 .
links externos
- hepático + lipase, + humano na Biblioteca Nacional de Medicina dos EUA Medical Subject Headings (MeSH)