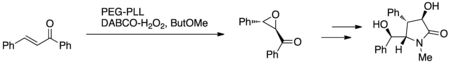Epoxidação Juliá-Colonna - Juliá–Colonna epoxidation
A epoxidação Julia-Colonna é um poli- assimétrica leucina catalisada nucleofílica epoxidação de olefinas deficientes em electrões em um sistema trifásico . A reação foi relatada por Sebastian Juliá no Instituto de Química de Sarriá em 1980, com posterior elaboração por Juliá e Stefano Colonna (Istituto di Chimica Industriale dell'Università, Milão, Itália).
No protocolo trifásico original, o substrato de chalcona é solúvel na fase orgânica, geralmente tolueno ou tetracloreto de carbono . O oxidante de peróxido de hidrogênio alcalino é solúvel principalmente na fase aquosa, e a reação ocorre na camada de polímero insolúvel na interface das duas fases. Protocolos bifásicos e monofásicos alternativos foram desenvolvidos com maior acessibilidade ao substrato e taxa de reação.
A eficiente epoxidação catalítica enantiosseletiva sob condições suaves é de grande utilidade sintética. Os epóxidos não são apenas sintons eficazes para uma série de transformações, mas também têm uma presença significativa nas estruturas de produtos naturais. Além disso, a reação foi efetivamente ampliada para níveis úteis industrialmente, com trabalho conduzido principalmente pela Bayer e Evonik . Finalmente, a atividade enzimática dos segmentos de poliaminoácidos sugere um papel da reação na origem prebiótica da vida .
Mecanismo de reação
A epoxidação Julia-Colonna é uma epoxidação assimétrica nucleofílico de deficientes em electrões olefinas , tais como a, p-insaturado cetonas . O mecanismo geral mostrado na Figura 2 se aplica a todas as epoxidações nucleofílicas, mas é controlado nesta reação pelo catalisador de polileucina.
O ânion hidroperóxido e a chalcona se reúnem em um complexo com o catalisador de polileucina antes de reagir para formar um intermediário enolato de peróxido. O intermediário subsequentemente fecha, conforme controlado pela estrutura do catalisador, para formar o produto epóxido estereosseletivamente.
Formação de complexo ternário
As cadeias de polileucina demonstram cinética semelhante à enzima com uma dependência de primeira ordem e eventual saturação com o ânion hidroperóxido (K M = 30 mM) e o substrato de olefina (K M = 110 mM.) O estudo cinético sugere que a reação prossegue por formação aleatória de estado estacionário de uma (polileucina + hidroperóxido anião + olefina) ternário complexo . Ambos os substratos devem se ligar antes da reação e, embora qualquer um possa se ligar primeiro, a ligação inicial do hidroperóxido é cineticamente preferida. O equilíbrio rápido que permite a formação do complexo é seguido pela formação de limitação da taxa do enolato de peróxido (Figura 3).
Origem mecanística da estereosseletividade
Todos os reagentes se associam ao catalisador de polileucina antes da reação para formar o intermediário enolato de hidroperóxido. O catalisador orienta os reagentes e, ainda mais significativamente, o peróxido enolato intermediário por uma série de interações de ligações de hidrogênio com os quatro grupos amino N-terminais na poli-leucina α-hélice . Enquanto outros modelos foram propostos, cálculos por Kelly et al. sugeriram que NH-2, NH-3 e NH-4 formam um triângulo isósceles disponível para ligações de hidrogênio como um orifício de oxiânion de estabilização intermediária . Embora a ligação da olefina à face endo ou exo da hélice seja estericamente permitida, apenas a ligação endo orienta o grupo NH-4 a se ligar à fração de hidroperóxido, permitindo o deslocamento do hidróxido na etapa de reação final (Figura 4).
Catalisador
Seleção de poli-aminoácidos
A enantiosseletividade é maximizada por sequências de poli-aminoácidos contendo o maior conteúdo em hélice α; estes incluem poli leucina e poli- alanina . Ambos os poli-L- e poli-D-aminoácidos estão disponíveis e causam a estereoindução oposta.
Geração de catalisador

Os catalisadores de poli-leucina originais foram formados pela reação de leucina-N-carboxianidridos com um iniciador, como uma amina, um álcool ou água (Figura 5). Em sistemas trifásicos, o catalisador de polímero deve ser embebido no solvente orgânico e solução de peróxido para gerar um gel antes da reação. - Especialmente em sistemas bifásicos, o tempo de reação pode ser reduzido e a enantiosseletividade aumentada pela ativação do catalisador com NaOH antes da reação. Além disso, em sistemas bifásicos, o polímero pode ser imobilizado em poliestireno , polietilenoglicol (PEG) ou sílica gel e formado em uma pasta.
Estrutura secundária do catalisador
O componente ativo do catalisador assume uma estrutura α-helicoidal onde os quatro a cinco resíduos do terminal N estão ativamente envolvidos na catálise. Embora catalisadores ativos tenham sido gerados a partir de leucina escalêmica , o conteúdo enantiomérico consistente deve ser mantido através da região N-terminal para dar a destreza adequada à estrutura. Embora a maior enantioseletividade tenha sido observada originalmente quando n = 30 resíduos, um polipeptídeo de leucina 10-mer é de comprimento suficiente para fornecer enantiosseletividade significativa Após a melhoria do procedimento original, maior enantiosseletividade foi observada para polímeros de baixo peso molecular, provavelmente devido ao número de terminais N disponíveis por massa usada.
Escopo
A epoxidação Juliá-Colonna de olefinas deficientes em elétrons foi demonstrada originalmente com chalconas, mas logo foi estendida a outros sistemas com frações que retiram elétrons, como cetonas α, β-insaturadas, ésteres e amidas. A reação também demonstrou eficiência com substratos de sulfona , e o escopo da reação está sendo expandido com mais investigação metodológica.
Diversas classes de substratos, entretanto, não são adequadas para a Epoxidação Juliá – Colonna. Esses incluem:
- compostos sensíveis ao hidróxido.
- compostos com prótons ácidos nas posições α ou α '.
- olefinas ricas em elétrons.
A epoxidação nucleofílica é naturalmente complementar em escopo às epoxidações eletrofílicas, como a epoxidação Sharpless e a epoxidação Jacobsen .
Estereosseletividade
Estrutura do catalisador
A estereoindução da epoxidação Juliá-Colonna é dependente da estrutura α-helicoidal secundária do catalisador poli-leucina. Embora a estereoquímica consistente dos aminoácidos N-terminais seja necessária para esta indução, mesmo um polipeptídeo de leucina 10-mer é de comprimento suficiente para fornecer enantiosseletividade significativa.
Amplificação quiral por catalisadores escalêmicos
Esta dependência apenas da região N-terminal da hélice é mais pronunciada na estereoindução enantiosseletiva por catalisadores escalêmicos. Mesmo um excesso enantiomérico de 40% de L vs. D-leucina na formação do catalisador pode produzir o mesmo epóxido enriquecido enantiomérico que o catalisador enantiomérico. A relação entre o catalisador e a enantiopureza do produto pode ser bastante aproximada com um modelo estatístico Bernoulliano : ee n = (L n -D n ) / (L n + D n ) onde L e D são as proporções de L- e D-leucina usadas para gerar os polímeros catalíticos e n é o comprimento do componente catalítico.
Aminoácidos quirais, incluindo a leucina, foram gerados em experimentos de descarga elétrica projetados para imitar as condições pré-bióticas na Terra e foram encontrados em misturas escalêmicas em meteoritos. Foi sugerido que fragmentos de poli-aminoácidos análogos ao catalisador Juliá-Colonna podem ter sido iniciados por derivados de imidazol ou cianeto , e os fragmentos resultantes podem ter desempenhado um papel catalítico na origem do enriquecimento enantiomérico onipresente na vida hoje.
Variações
Catalisadores enxertados com sílica
A polileucina enxertada com sílica demonstrou catalisar efetivamente a epoxidação de cetonas aromáticas α, β-insaturadas. O enxerto de sílica permite que o catalisador seja facilmente recuperado com apenas uma leve perda de atividade e é particularmente útil para reações de aumento de escala.
Condições de reação bifásica (não aquosa)
Para o protocolo bifásico alternativo, o substrato de olefina é dissolvido em tetra-hidrofurano (THF) juntamente com o oxidante de peróxido de hidrogênio de ureia (UHP) e uma base de amina terciária, como 8-diazabiciclo [5.4.0] undec-7-eno (DBU). O catalisador de polímero imobilizado forma uma pasta que serve como local de reação. As duas condições de reação de fase estenderam a faixa de enonas aos quais a reação poderia ser aplicada.
Condições de reação monofásica com polileucina imobilizada com PEG
Um iniciador solúvel O, O2-bis (2-aminoetil) polietilenoglicol (diaminoPEG) para montagem de poli-leucina foi utilizado para gerar um polímero tribloco solúvel em THF . Utilização deste catalisador na reacção homogénea condições activado marcado extensão da metodologia para α, p-insaturados cetonas , dienos , e bis -dienes.
Cocatálise de transferência de fase
A adição de brometo de tetrabutilamônio como catalisador de transferência de fase aumenta dramaticamente a taxa de reação. Presume-se que o cocatalisador aumente a concentração do peróxido oxidante na fase orgânica, permitindo um acesso mais eficiente ao complexo ternário reativo. Estas condições foram desenvolvidas para aplicação em sistemas bifásicos, mas também funcionam para sistemas trifásicos e têm sido utilizadas até a escala de 100g
Aumento de escala
Catalisadores imobilizados têm sido usados em reatores de membrana e estão sendo investigados para aplicação em reatores de leito fixo de fluxo contínuo.
Aplicações para síntese
Síntese total de Diltiazem
Adger et al. utilizou a epoxidação bifásica de Juliá-Colonna com poli-L-leucina (I-PLL) imobilizada e peróxido de hidrogênio de uréia (UHP) e 8-diazabiciclo [5.4.0] undec-7-eno (DBU) como a etapa principal no síntese eficiente de diltiazem (Figura 6.) O diltiazem é um fármaco comercialmente disponível que atua como um bloqueador dos canais de cálcio.
Síntese total de (+) - clausenamida
Cappi et al. utilizou a epoxidação Juliá-Colonna com poli-L-leucina imobilizada com PEG (PEG-PLL) e peróxido de hidrogênio DABCO (DABCO-H 2 O 2 ) ou peróxido de hidrogênio de uréia (UHP) em um sistema de reator de fluxo contínuo de leito fixo miniatura ( Figura 7.) Este protocolo foi explorado para sintetizar (+) - clausenamida como uma prova de conceito no desenvolvimento do novo protocolo de reação; (+) - clausenamida exibe atividade anti-amnésica e hepatoprotetora.
Síntese total de (+) - goniotriol 7, (+) - goniofufurona 8, (+) - 8-acetilgoniotriol 9 e gonio-pipirona
Chen et al. utilizou o protocolo bifásico de Epoxidação Juliá-Colonna com peróxido de hidrogênio da uréia (UHP), poli-L-leucina (PLL) e 8-diazabiciclo [5.4.0] undec-7-eno (DBU) como uma etapa chave na síntese de uma família de estiril lactonas isoladas de Goniothalamus giganteus (Figura 8.) Esses compostos, incluindo (+) - goniotriol 7, (+) - goniofufurona 8, (+) - 8-acetilgoniotriol 9 e goniopipirona, demonstraram atividade citotóxica contra células tumorais humanas.