Cetoacil sintase - Ketoacyl synthase
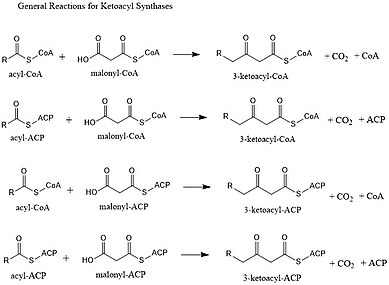
As cetoacil sintases (KSs) catalisam a reação de condensação de acil-CoA ou acil-acil ACP com malonil-CoA para formar 3-cetoacil-CoA ou com malonil-ACP para formar 3-cetoacil-ACP. Essa reação é uma etapa fundamental no ciclo de síntese de ácidos graxos, pois a cadeia de acila resultante é dois átomos de carbono a mais do que antes. Os KSs existem como enzimas individuais, como fazem na síntese de ácidos graxos do tipo II e na síntese de policetídeos do tipo II, ou como domínios em grandes enzimas de múltiplos domínios, como as sintases de ácidos graxos do tipo I (FASs) e as sintases de policetídeos (PKSs). Os KSs são divididos em cinco famílias: KS1, KS2, KS3, KS4 e KS5.
Sistemas enzimáticos de múltiplos domínios
Sintase de ácido graxo
A sintase de ácidos graxos (FAS) é o sistema enzimático envolvido na síntese de novo de ácidos graxos. FAS é uma multienzima iterativa que consiste em várias enzimas componentes, uma das quais é a cetoacil sintase. Existem dois tipos de FASs: tipo I e tipo II. Os FASs do tipo I são enzimas de múltiplos domínios altamente integradas. Eles contêm domínios funcionais discretos responsáveis por atividades catalíticas específicas da sequência de reação, seja em uma única cadeia polipeptídica ou em duas proteínas multifuncionais diferentes. Os FASs do tipo II são sistemas dissociados, o que significa que as enzimas componentes são proteínas independentes codificadas por uma série de genes separados.
Poliquetídeo sintase
As policetídeos sintases (PKS) são estrutural e funcionalmente relacionadas aos FAS, ambos enzimas que catalisam a condensação de metabólitos primários ativados, como acetil-CoA e malonil-CoA.
A principal reação que catalisam é:
- CO 2 -CH 2 -CO-S-CoA + CH 3 -CO-S-PKS → CH 3 -CO-CH 2 -CO-S-PKS + CoA-H + CO 2
Como os FASs, os PKSs usarão uma β-cetoacilsintase (KS), uma (malonil) acil transferase (MAT / AT) opcional e uma proteína carreadora de acila fosfopantetienilada (ACP) ou coenzima A (CoA). Eles também usaram uma cetoredutase, desidratase e enoil redutase para criar uma estrutura de acila totalmente saturada. Ao contrário dos FASs, no entanto, os PKSs normalmente usam um número maior de blocos de construção biossintéticos e formam um número mais variado de comprimentos de cauda. As etapas redutivas que os FASs usam também são opcionais para os PKSs. Ao omiti-los potencialmente, há potencial para um padrão mais complexo de funcionalização.
Existem três tipos principais de policetídeos: Tipo I, tipo II e tipo III. O tipo I é muito semelhante ao FAS tipo I, pois contém domínios catalíticos linearmente alinhados e covalentemente fundidos em grandes enzimas multifuncionais. O tipo II tende a ser um complexo mais dissociável com domínios de enzimas monofuncionais. Outra diferença entre os PKSs é que eles têm um outro tipo, o Tipo III. Os PKSs do tipo III são multifuncionais ao escolher uma unidade inicial, montar a corrente e promover a dobra.
Família 1 da cetoacil sintase
Quase todos os membros KS1 são produzidos por bactérias, com alguns formados por eucariotos e apenas um por um archaeon. Existem 12 subfamílias. A enzima dominante na família KS1 é a 3-cetoacil-ACP sintase III (KAS III), também conhecida como 3-oxoacil-ACP sintase III e β-cetoacil-ACP sintase III, e é definida como EC 2.3.1.180.
β-cetoacil-ACP sintase III
A reação característica da β-cetoacil-ACP sintase III é malonil-ACP + acetil-CoA => acetoacil-ACP + CO 2 + CoA. Cisteína, histidina e asparagina formam a tríade catalítica no KAS III, que usa o mecanismo cinético do pingue-pongue.
Em Escherichia coli , um organismo KAS III é tipicamente encontrado, KASIII é fracamente inibido pela tiolactomicina. No mesmo organismo, KAS III terá um pH ótimo de 7 e uma temperatura ótima de 30-37 ° C. Os inibidores, o pH ideal e as temperaturas ideais de cada organismo variam ligeiramente. No entanto, esses números são bastante indicativos do ambiente ideal da enzima em geral.
Família 2 da cetoacil sintase
Todas as enzimas KS2 são produzidas por eucariotos, quase todas de plantas. As enzimas mais comuns nesta família são 3-cetoacil-CoA sintases, elongases de ácidos graxos e enzimas de condensação de ácidos graxos de cadeia muito longa. A caracterização geral mais comum para essas enzimas é EC 2.3.1.-; no entanto, alguns são definidos como 2.3.1.119. A maioria das enzimas da família KS2 catalisa reações para produzir ácidos graxos de cadeia muito longa. KS2 pode ser dividido em 10 subfamílias.
3-cetoacil-CoA sintase I
A 3-cetoacil-CoA sintase I em Arabidopsis thaliana está envolvida na síntese de ácidos graxos de cadeia muito longa, que desempenha um papel na biossíntese da cera. A enzima catalisa a seguinte reação:
acil-CoA + malonil-CoA de cadeia muito longa ⇒ 3-oxoacil-CoA + CoA + CO 2 de cadeia muito longa
É uma elongase que parece estar envolvida na produção de ácidos graxos de cadeia muito longa, com 26 carbonos ou mais. O mefluidido e a perfluidona são inibidores seletivos dessa enzima.
Família 3 da cetoacil sintase
A família KS3 é a maior família do sistema KS, com 14 subfamílias. As enzimas KS3 são produzidas principalmente em bactérias, com um pequeno número de eucariotos e arquéias. Os KSs nesta família contêm domínios KS presentes em FASs Tipo I e no Tipo I modular de PKSs. Embora existam muitas enzimas ligeiramente diferentes nesta família, as duas mais comuns são a 3-cetoacil-ACP sintase I e a sintase II.
3-cetoacil-ACP sintase I
A 3-cetoacil-ACP sintase I ( EC 2.3.1.41 ) está envolvida no processo de alongamento da cadeia em FAS tipo II. Uma consequência de não ter essa enzima será um déficit de ácidos graxos insaturados. Ele usa tioésteres de acila graxos de ACP e CoA como substratos e tem uma especificidade próxima à da beta-cetoacil-ACP sintase II.
Normalmente, esta enzima é usada em reações de condensação, bem como descarboxilação e transferência de grupo acila.
A reação prossegue como tal:
- acil- [proteína transportadora de acila] + uma malonil- [proteína transportadora de acila] → uma 3-oxoacil- [proteína transportadora de acila] + CO2 + uma [proteína transportadora de acila]
Em Escherichia coli , por exemplo, esta enzima é usada para construir cadeias de acila graxas por meio de uma reação de condensação de Claisen de três etapas. A reação começará com uma trans-tioesterificação do substrato do primer acil. O substrato doador é então descarboxilado, formando um intermediário carbanião, que atacará C1 do substrato do primer e criará a cadeia de acila alongada.
Existem várias moléculas conhecidas como inibidoras da sintase I. Por exemplo, em certos casos, a própria acil-CoA inibe a enzima em altas concentrações em Escherichia coli. A cerulenina é conhecida por inibir a sintase I em Carthamus tinctorius , Spinacia oleracea , Brassica napus , Allium ampeloprasu , Streptococcus pneumoniae , Escherichia coli , Mycobacterium tuberculosis e muitos mais. No Mycobacterium tuberculosis , a palmitoil-CoA é um inibidor, e a tiolactomicina também o é em vários organismos.
A faixa de pH ideal varia muito de organismo para organismo, mas no geral tende a ficar entre 5,5-8,5. A temperatura ótima é a mesma, com 20 ° C em uma extremidade do espectro, mas 37 ° C na outra.
3-cetoacil-ACP sintase II
A 3-cetoacil-ACP sintase II está envolvida na FAS do tipo II que ocorre em plantas e bactérias. Embora muito semelhante à beta-cetoacil-ACP sintase I, há uma ligeira diferença entre os dois. Uma diferença principal é que a sintase II é capaz de usar facilmente palmitoleoil-ACP como substrato, enquanto a sintase I não pode. Isso permite o controle da regulação dependente da temperatura da composição de ácidos graxos.
A reação prossegue como tal:
- ( Z ) -hexadec-11-enoil- [proteína transportadora de acila] + malonil- [proteína transportadora de acila] → ( Z ) -3-oxooctadec-13-enoil- [proteína transportadora de acila] + CO 2 + [acila - proteína transportadora
Em Streptococcus pneumoniae , por exemplo, a sintase II é usada como uma enzima de condensação de alongamento. Ele contém uma tríade catalítica de Cys134, His337 e His303, bem como Phe396 e uma molécula de água ligada ao sítio ativo. A cisteína nucleofílica é necessária para a formação de acil-enzima e é usada na atividade geral de condensação. His 337 também é usado para a atividade de condensação, especificamente a estabilização da carga negativa no malonil tioéster carbonil no estado de transição. His303 é usado para acelerar a catálise por desprotonar a molécula de água para permitir um ataque nucleofílico ao malonato, liberando assim o bicarbonato. Phe396 atua como um porteiro controlando a ordem de adição de substrato.
Existem várias moléculas conhecidas por inibir essa enzima. Por exemplo, a cerulenina inibe a sintase II em Spinacia oleracea , Allium ampelprasum , Escherichia coli e Streptoccoccus pneumonia . Na Escherichia coli , a platensimicina, a tiolactomicina e a iodoacetamida também são inibidores conhecidos.
A faixa de pH ideal irá variar dependendo do organismo. Em Escherichia coli , o intervalo é de 5,5–6,1. Em Streptoccoccus pneumoniae , 6,8-7, em Plasmodium falciparum 7,5 e em Spinacia oleracea , 8,1-8,5. A temperatura ideal pode variar, mas a maior parte permanece na faixa de 30–37 ° C.
Família 4 da cetoacil sintase
A maioria das enzimas KS4 existe em organismos eucarióticos, enquanto o restante é de bactérias. Essas enzimas são normalmente classificadas como chalcona sintases, estilbeno sintases ou PKSs do tipo III. No geral, existem 10 subfamílias diferentes dentro de KS4. Normalmente, os membros KS4 terão uma tríade catalítica Cys-His-Asn. Ambas as chalcona sintases e estilbeno sintases catalisarão a mesma transferência de acila, descarboxilação e etapas de condensação como em KS1. No entanto, eles também ciclizarão e aromatizarão as reações antes que o produto de chalcona final seja formado.
Chalcone sintase
A chalcona sintase ( EC 2.3.1.74 ), também conhecida como naringenina-chalcona sintase, é responsável pela reação:
- 3 malonil-CoA + 4-coumaroil-CoA → 4 CoA + naringenina chalcona + 3 CO 2
No Medicago sativa , por exemplo, a reação ocorre ao longo de uma etapa de carregamento, uma etapa de descarboxilação e, finalmente, uma etapa de alongamento.
Vários inibidores incluem cerulenina em Sinapis alba, Daucus carota e Phaseolus vulgaris , apigenina em cereais Secale e Avena sativa e eriodictiol em cereais Decale, Daucus carota e Xanthisma gracile.
O pH ideal no qual essa enzima pode funcionar varia entre os organismos, mas normalmente é colocado em algum lugar entre 6 e 8. O mesmo se aplica à temperatura ideal de 30-45 ° C.
Família 5 da cetoacil sintase
Os membros da família KS5 estão todos presentes em células eucarióticas, principalmente animais. A maioria dessas enzimas pode ser classificada como elongases de ácidos graxos. Essas enzimas são conhecidas por serem usadas no alongamento de ácidos graxos de cadeia muito longa. KS5 tem 11 subfamílias. Pouco ainda se sabe sobre a família KS5. Atualmente, nenhuma das enzimas específicas tem números EC. Nenhum resíduo da tríade catalítica foi confirmado. Resíduos conservados de histidina e asparagina foram encontrados, com a histidina em uma região que atravessa a membrana. No entanto, ainda não existem resíduos de cisteína conservados conhecidos.