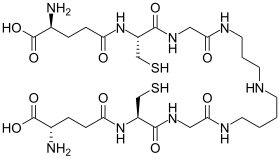
Tripanotiona - Trypanothione
|
|
 Forma reduzida (superior) e forma oxidada (inferior)
|
|
| Nomes | |
|---|---|
| Outros nomes
N1 , N8 -Bis (glutationil) espermidina
|
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| ChEBI | |
| ChemSpider | |
|
PubChem CID
|
|
|
Painel CompTox ( EPA )
|
|
|
|
|
|
| Propriedades | |
| C 27 H 47 N 9 O 10 S 2 (oxidado) C 27 H 49 N 9 O 10 S 2 (reduzido) |
|
| Massa molar | 721,84 g / mol (oxidado) 723,86 g / mol (reduzido) |
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Referências da Infobox | |
Tripanotiona é uma forma incomum de glutationa que contém duas moléculas de glutationa unidas por um ligante de espermidina ( poliamina ). É encontrado em protozoários parasitas, como leishmania e tripanossomos . Esses parasitas protozoários são a causa da leishmaniose , doença do sono e doença de Chagas . Tripanotiona foi descoberta por Alan Fairlamb . Sua estrutura foi comprovada por síntese química. É exclusivo do Kinetoplastida e não é encontrado em outros protozoários parasitas, como Entamoeba histolytica . Como esse tiol está ausente no homem e é essencial para a sobrevivência dos parasitas, as enzimas que fabricam e usam essa molécula são alvos para o desenvolvimento de novos medicamentos para o tratamento dessas doenças.
As enzimas dependentes de tripanotiona incluem redutases , peroxidases , glioxalases e transferases . Tripanotiona-dissulfeto redutase (TryR) foi a primeira enzima dependente de tripanotiona a ser descoberta ( EC 1.8.1.12 ). É uma flavoenzima dependente de NADPH que reduz o dissulfeto de tripanotiona. TryR é essencial para a sobrevivência desses parasitas tanto in vitro quanto no hospedeiro humano.
Uma das principais funções da tripanotiona é a defesa contra o estresse oxidativo . Aqui, enzimas dependentes de tripanotiona, como a tripparedoxina peroxidase ( TryP ), reduzem os peróxidos usando elétrons doados diretamente da tripanotiona ou por meio da triparedoxina intermediária redox ( TryX ). O metabolismo do peróxido de hidrogênio dependente da tripanotiona é particularmente importante nesses organismos porque carecem de catalase . Como os tripanossomatídeos também carecem de um equivalente da tioredoxina redutase , a tripanotiona redutase é o único caminho que os elétrons podem seguir do NADPH para essas enzimas antioxidantes.

