Fluorinase - Fluorinase
| Fluorinase (adenosil-fluoreto sintase) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| Identificadores | |||||||||
| EC nº | 2.5.1.63 | ||||||||
| Bancos de dados | |||||||||
| IntEnz | Vista IntEnz | ||||||||
| BRENDA | Entrada BRENDA | ||||||||
| ExPASy | NiceZyme view | ||||||||
| KEGG | Entrada KEGG | ||||||||
| MetaCyc | via metabólica | ||||||||
| PRIAM | perfil | ||||||||
| Estruturas PDB | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
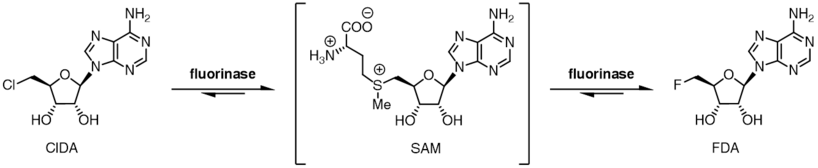
A enzima fluorinase ( EC 2.5.1.63 , também conhecida como adenosil-fluoreto sintase) catalisa a reação entre o íon fluoreto e o cofator S -adenosil-L-metionina para gerar L-metionina e 5'-fluoro-5'-desoxiadenosina , o primeiro produto comprometido da via de biossíntese do fluorometabólito. A fluorinase foi originalmente isolada da bactéria do solo Streptomyces cattleya , mas homólogos foram identificados em várias outras espécies bacterianas, incluindo Streptomyces sp. MA37, Nocardia brasiliensis e Actinoplanessp. N902-109. Esta é a única enzima conhecida capaz de catalisar a formação de uma ligação carbono-flúor, a ligação simples mais forte da química orgânica.

Um homólogo chlorinase enzima, que catalisa a mesma reacção com cloreto de em vez de ião fluoreto, foi isolado a partir de Salinospora tropica , da via biossintética de um salinosporamide .
Reatividade
A fluorinase catalisa uma substituição nucleofílica do tipo S N 2 na posição C-5 'de SAM, enquanto a L-metionina atua como um grupo de saída neutro. A reação catalisada por fluorinase é estimada entre 10 6 a 10 15 vezes mais rápida do que a reação não catalisada, um aumento significativo da taxa. Apesar disso, a fluorinase ainda é considerada uma enzima lenta, com um número de turnover ( k cat ) de 0,06 min -1 . A alta barreira cinética à reação é atribuída à forte solvatação do íon fluoreto na água, resultando em uma alta energia de ativação associada à separação das moléculas de água solvatadas do íon fluoreto aquoso, convertendo o fluoreto em um potente nucleófilo dentro do sítio ativo.
A reação catalisada pela fluorinase é reversível, e após incubação de 5'-fluoro-5'-desoxiadenosina e L-metionina com a fluorinase, SAM e íon fluoreto são produzidos. A substituição da L-metionina por L-selenometionina resulta em um aumento de 6 vezes na taxa da reação reversa, devido ao aumento da nucleofilicidade do centro de selênio em comparação com o centro de enxofre.
A fluorinase mostra um grau de tolerância do substrato para o íon haleto e também pode usar o íon cloreto no lugar do íon fluoreto. Enquanto o equilíbrio para a reação entre o SAM e o íon fluoreto está em relação aos produtos FDA e L-metionina, a posição de equilíbrio é invertida no caso do íon cloreto. A incubação de SAM e íon cloreto com a fluorinase não resulta na geração de 5'-cloro-5'-desoxiadenosina (ClDA), a menos que uma enzima adicional, uma L- aminoácido oxidase , seja adicionada. O aminoácido oxidase remove a L-metionina da reação, convertendo-a no oxoácido correspondente.

A preferência de haleto, acoplada à posição dos dois equilíbrios de reação permite que uma reação de transhalogenação líquida seja catalisada pela enzima. A incubação de 5'-cloro nucleosídeos com a enzima, junto com L-selenometionina catalítica ou L-metionina, resulta na produção de 5-fluoro nucleosídeos. Quando o [ 18 F] fluoreto é usado, essa reação de transhalogenação pode ser usada para a síntese de radiotraçadores para tomografia por emissão de pósitrons .
Estudos estruturais
No final de 2007, 9 estruturas foram resolvidas para esta classe de enzimas, com códigos de acesso PDB 1RQP , 1RQR , 2C2W , 2C4T , 2C4U , 2C5B , 2C5H , 2CBX e 2CC2 .
Os nomes dados à enzima não vêm da estrutura, mas da função: 5-Fluoro-5-desoxiadenosina é a molécula sintetizada. A estrutura é homóloga à série de enzimas duf-62 . A enzima é um dímero de trímeros (2 moléculas cada uma com três subunidades). Os sítios ativos estão localizados entre essas subunidades (interfaces de subunidades), cada um pode se ligar a uma molécula de SAM por vez.